Filtru
Întâi cele populare
Întâi cele populare
0
În stoc
Păstraţi acest prospect. S-ar putea să fie necesar să-l recitiţi.
Dacă aveţi orice întrebări suplimentare, adresaţi-vă medicului dumneavoastră sau farmacistului.
Acest medicament a fost prescris pentru dumneavoastră. Nu trebuie să-l daţi altor persoane. Le poate face rău, chiar dacă au aceleaşi semne de boală ca şi dumneavoastră.
Dacă manifestaţi orice reacţii adverse, adresaţi-vă medicului dumneavoastră sau farmacistului. Acestea includ orice posibile reacţii adverse nemenţionate în acest prospect. Vezi pct.
Ce găsiţi în acest prospect:
Ce este VENOSMIL şi pentru ce se utilizează
Ce trebuie să ştiţi înainte să utilizaţi VENOSMIL
Cum să utilizaţi VENOSMIL
Reacţii adverse posibile
Cum se păstrează VENOSMIL
Conţinutul ambalajului şi alte informaţii
Ce este VENOSMIL şi pentru ce se utilizează
VENOSMIL conţine în calitate de substanţa activă hidrosmina, un medicament este un venotonic (creşte tonusul pereţilor venoşi) şi vasoprotector (creşte rezistenţa pereţilor vaselor mici de sânge).
VENOSMIL este utilizat la adulţi pentru ameliorarea simptomelor asociate cu insuficienţă venoasă cronică uşoară: durere, picioare grele, senzaţie de apăsare, furnicături, înţepături la nivelul picioarelor cu varice şi picioare umflate.
Ce trebuie să ştiţi înainte să utilizaţi VENOSMIL
Nu luaţi VENOSMIL:
dacă sunteţi alergic (hipersensibil) la hidrosmină sau la oricare dintre excipienţii medicamentului, enumeraţi la pct.
Atenţionări şi precauţii
Înainte de a utiliza medicamentul consultaţi medicul dumneavoastră sau farmacistul.
Nu utilizaţi acest medicament pentru perioade lungi de timp fără supraveghere medicală.
Copii şi adolescenţi
Utilizarea VENOSMIL nu se recomandă la copii şi adolescenţi.
VENOSMIL împreună cu alte medicamente
Vă rugăm să spuneţi medicului dumneavoastră sau farmacistului dacă luaţi, aţi luat recent sau intenţionaţi să luaţi alte medicamente, inclusiv medicamente eliberate fără prescripţie medicală.
Nu au fost observate interacţiuni cu alte medicamente, cu toate acestea nu trebuie să luaţi decizia de a lua alte medicamente, cu excepţia cazului, când acestea au fost recomandate de către medicul dumneavoastră.
VENOSMIL împreună cu alimente
Nu se cunosc interacţiuni ale hidrosminei cu alimentele.
Fertilitatea, sarcina şi alăptarea
Dacă sunteţi gravidă sau alăptaţi, credeţi că aţi putea deveni gravidă sau intenţionaţi să deveniţi gravidă, adresaţi-vă medicului dumneavoastră sau farmacistului înainte de a utiliza orice medicament.
Nu sunt disponibile date clinice privind utilizarea VENOSMIL la femeile gravide. Ca o măsură de precauţie, VENOSMIL nu se recomandă în timpul sarcinii, cu excepţia cazurilor în care, în opinia medicului, beneficiile scontate pentru mamă depăşesc riscul potenţial pentru făt.
Nu sunt disponibile date clinice privind utilizarea hidrosminei la femeile care alăptează. Nu se cunoaşte dacă hidrosmina trece în laptele matern uman, prin urmare, utilizarea ei în timpul alăptării nu se recomandă.
Conducerea vehiculelor şi folosirea utilajelor
VENOSMIL nu influenţează sau influenţează în mod nesemnificativ asupra capacităţii de a conduce vehicule şi de a folosi utilaje.
Cum să utilizaţi VENOSMIL
Utilizaţi întotdeauna acest medicament exact aşa cum v-a spus medicul. Discutaţi cu medicul dumneavoastră sau cu farmacistul dacă nu sunteţi sigur.
Doze
Adulţi
Câte 1 capsulă a câte 200 mg de trei ori pe zi, de obicei cu mesele principale.
Copii şi adolescenţi
Utilizarea VENOSMIL nu se recomandă la copii şi adolescenţi.
Mod de administrare
Administrare orală.
Odată scoasă din blister, capsula trebuie administrată imediat. Acesta poate fi luată cu apă sau cu altă băutură pentru a ajuta înghiţirea ei.
În cazul în care simptomele nu se ameliorează timp de 2 săptămâni, este necesar de reevaluat starea clinică.
În caz de necesitate, tratamentul poate fi continuat cu aceeaşi doză zilnică până la 2-3 luni.
Dacă aţi luat mai mult decât trebuie VENOSMIL
În caz de supradozaj sau ingestie accidentală, adresaţi-vă imediat la medic sau la secţia de urgenţă a celui mai apropiat spital.
Dacă aţi omis o doză de VENOSMIL
Dacă aţi uitat să luaţi o doză de VENOSMIL, luaţi-o imediat ce vă amintiţi, cu excepţia cazului în care este aproape timpul pentru doza următoare.
Nu luaţi niciodată o doză dublă pentru a compensa doza omisă.
Dacă aţi încetat să luaţi VENOSMIL
Dacă aveţi orice întrebări suplimentare cu privire la acest medicament, adresaţi-vă medicului dumneavoastră sau farmacistului.
Reacţii adverse posibile
Ca şi toate medicamentele, acest medicament poate provoca reacţii adverse, cu toate că nu apar la toate persoanele.
Reacţii adverse cu frecvenţă necunoscută (care nu poate fi estimată din datele disponibile):
reacţii de hipersensibilitate (alergie) la substanţa activă (hidrosmină) sau la oricare dintre excipienţi;
dureri de cap, ameţeli;
dureri în regiunea stomacului, greţuri,
erupţii cutanate, mâncărimea pielii.
Raportarea reacţiilor adverse
Dacă manifestaţi orice reacţii adverse, adresaţi-vă medicului dumneavoastră sau farmacistului. Acestea includ orice posibile reacţii adverse nemenţionate în acest prospect.
Cum se păstrează VENOSMIL
Nu lăsaţi acest medicament la vederea şi îndemâna copiilor.
A se păstra la temperaturi sub 30 °C.
Nu utilizaţi acest medicament după data de expirare înscrisă pe cutie. Data de expirare se referă la ultima zi a lunii respective.
Nu aruncaţi nici un medicament pe calea apei menajere sau a reziduurilor menajere. Întrebaţi farmacistul cum să aruncaţi medicamentele pe care nu le mai folosiţi. Aceste măsuri vor ajuta la protejarea mediului.
Conţinutul ambalajului şi alte informaţii
Ce conţine VENOSMIL mg
Substanţa activă este hidrosmina.
1 capsulă conţine hidrosmină 200 mg.
Celelalte componente sunt: stearat de magneziu.
Compoziţia capsulei: gelatină, eritrozină (E 127), galben de chinolină (E 104), dioxid de titan (E 171), apă.
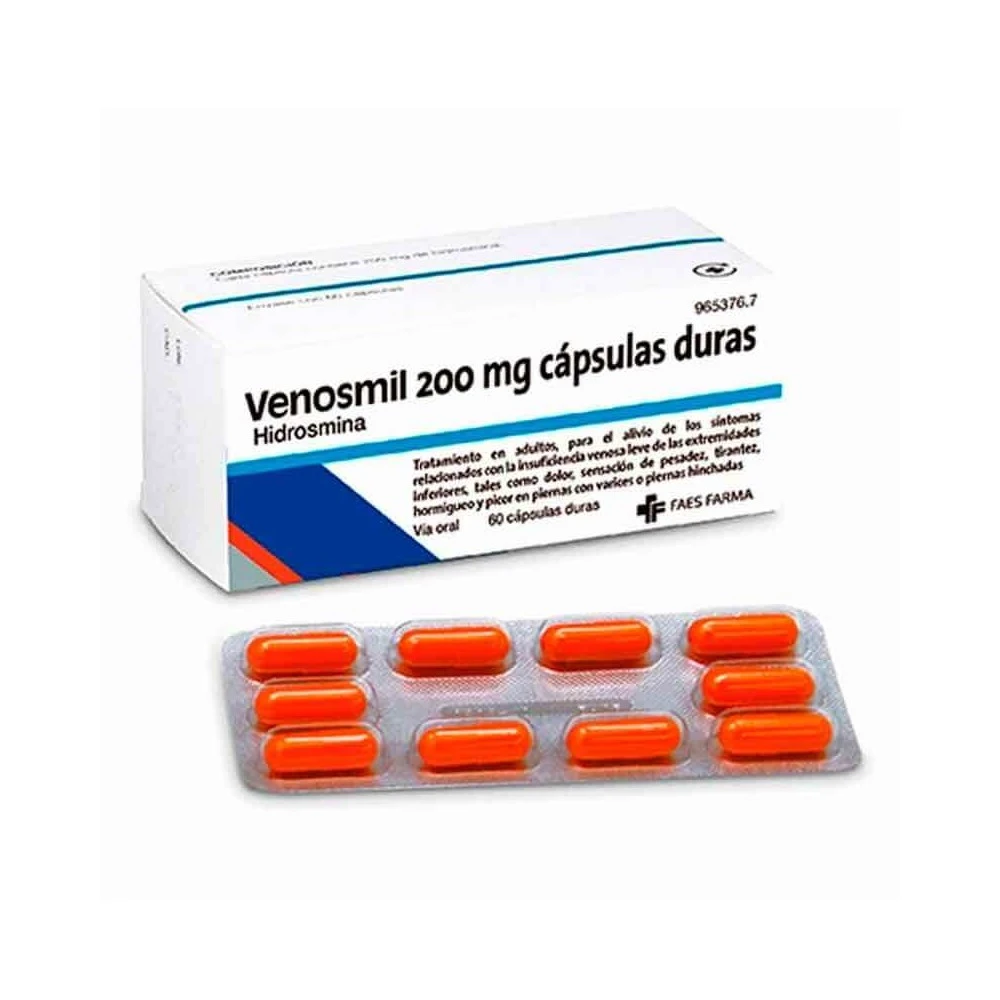
Cum arată VENOSMIL şi conţinutul ambalajului
VENOSMIL se prezintă sub formă de capsule gelatinoase tari de culoare oranj, care conţin pulbere de culoare galbenă.
VENOSMIL este disponibil în cutii cu 6 blistere din Al/Al a câte 10 capsule.
Dacă aveţi orice întrebări suplimentare, adresaţi-vă medicului dumneavoastră sau farmacistului.
Acest medicament a fost prescris pentru dumneavoastră. Nu trebuie să-l daţi altor persoane. Le poate face rău, chiar dacă au aceleaşi semne de boală ca şi dumneavoastră.
Dacă manifestaţi orice reacţii adverse, adresaţi-vă medicului dumneavoastră sau farmacistului. Acestea includ orice posibile reacţii adverse nemenţionate în acest prospect. Vezi pct.
Ce găsiţi în acest prospect:
Ce este VENOSMIL şi pentru ce se utilizează
Ce trebuie să ştiţi înainte să utilizaţi VENOSMIL
Cum să utilizaţi VENOSMIL
Reacţii adverse posibile
Cum se păstrează VENOSMIL
Conţinutul ambalajului şi alte informaţii
Ce este VENOSMIL şi pentru ce se utilizează
VENOSMIL conţine în calitate de substanţa activă hidrosmina, un medicament este un venotonic (creşte tonusul pereţilor venoşi) şi vasoprotector (creşte rezistenţa pereţilor vaselor mici de sânge).
VENOSMIL este utilizat la adulţi pentru ameliorarea simptomelor asociate cu insuficienţă venoasă cronică uşoară: durere, picioare grele, senzaţie de apăsare, furnicături, înţepături la nivelul picioarelor cu varice şi picioare umflate.
Ce trebuie să ştiţi înainte să utilizaţi VENOSMIL
Nu luaţi VENOSMIL:
dacă sunteţi alergic (hipersensibil) la hidrosmină sau la oricare dintre excipienţii medicamentului, enumeraţi la pct.
Atenţionări şi precauţii
Înainte de a utiliza medicamentul consultaţi medicul dumneavoastră sau farmacistul.
Nu utilizaţi acest medicament pentru perioade lungi de timp fără supraveghere medicală.
Copii şi adolescenţi
Utilizarea VENOSMIL nu se recomandă la copii şi adolescenţi.
VENOSMIL împreună cu alte medicamente
Vă rugăm să spuneţi medicului dumneavoastră sau farmacistului dacă luaţi, aţi luat recent sau intenţionaţi să luaţi alte medicamente, inclusiv medicamente eliberate fără prescripţie medicală.
Nu au fost observate interacţiuni cu alte medicamente, cu toate acestea nu trebuie să luaţi decizia de a lua alte medicamente, cu excepţia cazului, când acestea au fost recomandate de către medicul dumneavoastră.
VENOSMIL împreună cu alimente
Nu se cunosc interacţiuni ale hidrosminei cu alimentele.
Fertilitatea, sarcina şi alăptarea
Dacă sunteţi gravidă sau alăptaţi, credeţi că aţi putea deveni gravidă sau intenţionaţi să deveniţi gravidă, adresaţi-vă medicului dumneavoastră sau farmacistului înainte de a utiliza orice medicament.
Nu sunt disponibile date clinice privind utilizarea VENOSMIL la femeile gravide. Ca o măsură de precauţie, VENOSMIL nu se recomandă în timpul sarcinii, cu excepţia cazurilor în care, în opinia medicului, beneficiile scontate pentru mamă depăşesc riscul potenţial pentru făt.
Nu sunt disponibile date clinice privind utilizarea hidrosminei la femeile care alăptează. Nu se cunoaşte dacă hidrosmina trece în laptele matern uman, prin urmare, utilizarea ei în timpul alăptării nu se recomandă.
Conducerea vehiculelor şi folosirea utilajelor
VENOSMIL nu influenţează sau influenţează în mod nesemnificativ asupra capacităţii de a conduce vehicule şi de a folosi utilaje.
Cum să utilizaţi VENOSMIL
Utilizaţi întotdeauna acest medicament exact aşa cum v-a spus medicul. Discutaţi cu medicul dumneavoastră sau cu farmacistul dacă nu sunteţi sigur.
Doze
Adulţi
Câte 1 capsulă a câte 200 mg de trei ori pe zi, de obicei cu mesele principale.
Copii şi adolescenţi
Utilizarea VENOSMIL nu se recomandă la copii şi adolescenţi.
Mod de administrare
Administrare orală.
Odată scoasă din blister, capsula trebuie administrată imediat. Acesta poate fi luată cu apă sau cu altă băutură pentru a ajuta înghiţirea ei.
În cazul în care simptomele nu se ameliorează timp de 2 săptămâni, este necesar de reevaluat starea clinică.
În caz de necesitate, tratamentul poate fi continuat cu aceeaşi doză zilnică până la 2-3 luni.
Dacă aţi luat mai mult decât trebuie VENOSMIL
În caz de supradozaj sau ingestie accidentală, adresaţi-vă imediat la medic sau la secţia de urgenţă a celui mai apropiat spital.
Dacă aţi omis o doză de VENOSMIL
Dacă aţi uitat să luaţi o doză de VENOSMIL, luaţi-o imediat ce vă amintiţi, cu excepţia cazului în care este aproape timpul pentru doza următoare.
Nu luaţi niciodată o doză dublă pentru a compensa doza omisă.
Dacă aţi încetat să luaţi VENOSMIL
Dacă aveţi orice întrebări suplimentare cu privire la acest medicament, adresaţi-vă medicului dumneavoastră sau farmacistului.
Reacţii adverse posibile
Ca şi toate medicamentele, acest medicament poate provoca reacţii adverse, cu toate că nu apar la toate persoanele.
Reacţii adverse cu frecvenţă necunoscută (care nu poate fi estimată din datele disponibile):
reacţii de hipersensibilitate (alergie) la substanţa activă (hidrosmină) sau la oricare dintre excipienţi;
dureri de cap, ameţeli;
dureri în regiunea stomacului, greţuri,
erupţii cutanate, mâncărimea pielii.
Raportarea reacţiilor adverse
Dacă manifestaţi orice reacţii adverse, adresaţi-vă medicului dumneavoastră sau farmacistului. Acestea includ orice posibile reacţii adverse nemenţionate în acest prospect.
Cum se păstrează VENOSMIL
Nu lăsaţi acest medicament la vederea şi îndemâna copiilor.
A se păstra la temperaturi sub 30 °C.
Nu utilizaţi acest medicament după data de expirare înscrisă pe cutie. Data de expirare se referă la ultima zi a lunii respective.
Nu aruncaţi nici un medicament pe calea apei menajere sau a reziduurilor menajere. Întrebaţi farmacistul cum să aruncaţi medicamentele pe care nu le mai folosiţi. Aceste măsuri vor ajuta la protejarea mediului.
Conţinutul ambalajului şi alte informaţii
Ce conţine VENOSMIL mg
Substanţa activă este hidrosmina.
1 capsulă conţine hidrosmină 200 mg.
Celelalte componente sunt: stearat de magneziu.
Compoziţia capsulei: gelatină, eritrozină (E 127), galben de chinolină (E 104), dioxid de titan (E 171), apă.
Cum arată VENOSMIL şi conţinutul ambalajului
VENOSMIL se prezintă sub formă de capsule gelatinoase tari de culoare oranj, care conţin pulbere de culoare galbenă.
VENOSMIL este disponibil în cutii cu 6 blistere din Al/Al a câte 10 capsule.
0
În stoc
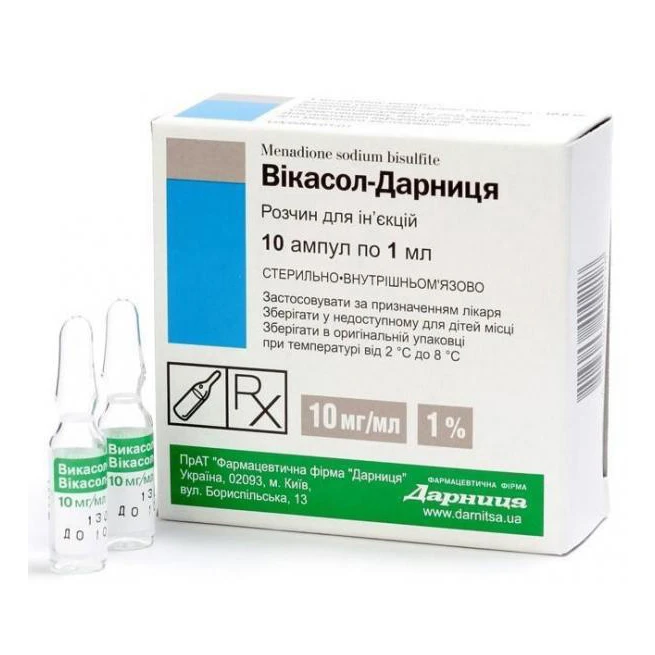
INDICAŢII TERAPEUTICE
Hemoragii postoperatorii și alte stări patologice determinate de creșterea activității fibrinolitice a sângelui și țesuturilor. Profilaxia dezvoltării hipofibrinogenemiei secundare în cazul perfuziilor masive de sânge conservat.
Certificat de înregistrare al medicamentului nr. 20512 din 21.03.2014
Tratamentul și profilaxia gripei și infecțiilor virale respiratorii acute la copii și adulți.
DOZE ŞI MOD DE ADMINISTRARE
Soluția de acid aminocapronic se administrează pe cale orală sau intravenos.
Pe cale orală, la adulți se administrează câte 5 g (100 ml) soluție, apoi la fiecare oră câte 1 g (20 ml) timp de 8 ore până la oprirea completă a hemoragiei.
Pentru a obține un efect rapid (în hipofibrinogenemia acută) preparatul se administrează intravenos în perfuzie până la 100 ml (5 g) cu viteza de 50-60 picături pe minut timp de 15-30 minute. În timpul primei ore se administrează în doză de 4-5 g, iar în caz de hemoragie îndelungată, până la oprirea ei completă – se administrează la fiecare oră câte 1 g, nu mai mult de 8 ore.
În caz de hemoragie repetată, se administrează repetat soluția de acid aminocapronic 5%.
Administrarea la copii
La creșterea moderată a activității fibrinolitice, acidul aminocapronic se administrează în doză unică câte 0,05 g/kg masă corporală pe zi.
Doza, în dependență de vârstă constituie:
- copii cu vârsta până la 1 an: doza unică – până la 2,5 ml, doza zilnică – 15 ml;
- copii cu vârsta de la 2 la 6 ani: doza unică – 2,5-5 ml, doza zilnică – 15-30 ml;
- copii cu vârsta de la 7 la 10 ani: doza unică – 5-7 ml, doza zilnică – 30-45 ml.
În cazul hemoragiilor acute doza constituie:
- copii cu vârsta până la 1 an: doza unică – 5 ml, doza zilnică – 30 ml;
- copii cu vârsta de la 2 la 4 ani: doza unică – 5-7,5 ml, doza zilnică – 30-45 ml;
- copii cu vîrsta de la 5 la 8 ani: doza unică – 7,5-10 ml, doza zilnică – 45-60 ml;
- copii cu vârsta de la 9 la 10 ani: doza unică – 15 ml, doza zilnică – 90 ml.
Durata tratamentului – de la 3 până la 14 zile.
Cu scop de profilaxie și tratament al gripei și infecțiilor virale respiratorii acute medicamenul se administrează pe cale orală și local (câte 0,5-1 ml intranazal de 3-4 ori pe zi).
Pe cale orală, copiilor medicamentul se administrează în următoarele doze:
- copii cu vârsta până la 2 ani: 1-2 g (20-40 ml soluție de acid aminocaproic 5% pe zi) - câte 1-2 lingurițe de 4 ori pe zi (doza unică – 0,02-0,04 g/kg), poate fi adăugată în alimente sau lichide;
- copii cu vârsta de la 2 la 6 ani: 2-4 g (40-80 ml soluție de acid aminocaproic 5%) – câte 1-2 linguri de 4 ori pe zi;
- copii cu vârsta de la 7 ani și adulți: câte 4-5 g (80-100 ml soluție de acid aminocaproic 5% în 24 ore), divizate în 4 prize.
Pentru un dozaj mai exact se recomandă utilizarea unei seringi fară ac, cu volumul de 10 sau 20 ml.
În același timp, este argumentată administrarea locală a acidului aminocapronic. Se recomandă la fiecare 3-4 ore să se plaseze în căile nazale timp de 5-10 minute tampoane de vată umezite cu soluție de acid aminocapronic de 5% sau în termenii indicați să se administreze câte 3-5 picături de soluție în fiecare meat nazal.
Acidul aminocapronic poate fi utilizat, dacă este necesar, în combinație cu alte medicamente antivirale, interferon și inductorii săi.
Acidul aminocapronic se administrează intranazal, în scop profilactic în perioada epidemiei de gripă (de 3-4 ori pe zi), poate fi suplimentat cu administrarea per os a medicamentului în focarele de infecție.
Durata administrării orale a acidului aminocapronic în gripă și infecțiile virale respiratorii acute este de 3-7 zile.
Cura de tratament depinde de severitatea bolii și este determinată de medic în mod individual. De asemenea, medicul poate ajusta doza și indica o cură de tratament repetată.
Hemoragii postoperatorii și alte stări patologice determinate de creșterea activității fibrinolitice a sângelui și țesuturilor. Profilaxia dezvoltării hipofibrinogenemiei secundare în cazul perfuziilor masive de sânge conservat.
Certificat de înregistrare al medicamentului nr. 20512 din 21.03.2014
Tratamentul și profilaxia gripei și infecțiilor virale respiratorii acute la copii și adulți.
DOZE ŞI MOD DE ADMINISTRARE
Soluția de acid aminocapronic se administrează pe cale orală sau intravenos.
Pe cale orală, la adulți se administrează câte 5 g (100 ml) soluție, apoi la fiecare oră câte 1 g (20 ml) timp de 8 ore până la oprirea completă a hemoragiei.
Pentru a obține un efect rapid (în hipofibrinogenemia acută) preparatul se administrează intravenos în perfuzie până la 100 ml (5 g) cu viteza de 50-60 picături pe minut timp de 15-30 minute. În timpul primei ore se administrează în doză de 4-5 g, iar în caz de hemoragie îndelungată, până la oprirea ei completă – se administrează la fiecare oră câte 1 g, nu mai mult de 8 ore.
În caz de hemoragie repetată, se administrează repetat soluția de acid aminocapronic 5%.
Administrarea la copii
La creșterea moderată a activității fibrinolitice, acidul aminocapronic se administrează în doză unică câte 0,05 g/kg masă corporală pe zi.
Doza, în dependență de vârstă constituie:
- copii cu vârsta până la 1 an: doza unică – până la 2,5 ml, doza zilnică – 15 ml;
- copii cu vârsta de la 2 la 6 ani: doza unică – 2,5-5 ml, doza zilnică – 15-30 ml;
- copii cu vârsta de la 7 la 10 ani: doza unică – 5-7 ml, doza zilnică – 30-45 ml.
În cazul hemoragiilor acute doza constituie:
- copii cu vârsta până la 1 an: doza unică – 5 ml, doza zilnică – 30 ml;
- copii cu vârsta de la 2 la 4 ani: doza unică – 5-7,5 ml, doza zilnică – 30-45 ml;
- copii cu vîrsta de la 5 la 8 ani: doza unică – 7,5-10 ml, doza zilnică – 45-60 ml;
- copii cu vârsta de la 9 la 10 ani: doza unică – 15 ml, doza zilnică – 90 ml.
Durata tratamentului – de la 3 până la 14 zile.
Cu scop de profilaxie și tratament al gripei și infecțiilor virale respiratorii acute medicamenul se administrează pe cale orală și local (câte 0,5-1 ml intranazal de 3-4 ori pe zi).
Pe cale orală, copiilor medicamentul se administrează în următoarele doze:
- copii cu vârsta până la 2 ani: 1-2 g (20-40 ml soluție de acid aminocaproic 5% pe zi) - câte 1-2 lingurițe de 4 ori pe zi (doza unică – 0,02-0,04 g/kg), poate fi adăugată în alimente sau lichide;
- copii cu vârsta de la 2 la 6 ani: 2-4 g (40-80 ml soluție de acid aminocaproic 5%) – câte 1-2 linguri de 4 ori pe zi;
- copii cu vârsta de la 7 ani și adulți: câte 4-5 g (80-100 ml soluție de acid aminocaproic 5% în 24 ore), divizate în 4 prize.
Pentru un dozaj mai exact se recomandă utilizarea unei seringi fară ac, cu volumul de 10 sau 20 ml.
În același timp, este argumentată administrarea locală a acidului aminocapronic. Se recomandă la fiecare 3-4 ore să se plaseze în căile nazale timp de 5-10 minute tampoane de vată umezite cu soluție de acid aminocapronic de 5% sau în termenii indicați să se administreze câte 3-5 picături de soluție în fiecare meat nazal.
Acidul aminocapronic poate fi utilizat, dacă este necesar, în combinație cu alte medicamente antivirale, interferon și inductorii săi.
Acidul aminocapronic se administrează intranazal, în scop profilactic în perioada epidemiei de gripă (de 3-4 ori pe zi), poate fi suplimentat cu administrarea per os a medicamentului în focarele de infecție.
Durata administrării orale a acidului aminocapronic în gripă și infecțiile virale respiratorii acute este de 3-7 zile.
Cura de tratament depinde de severitatea bolii și este determinată de medic în mod individual. De asemenea, medicul poate ajusta doza și indica o cură de tratament repetată.
0
În stoc
Hemopran Supozitoare protectoare endorectale
Hemopran Supozitoare protectoare endorectale sunt destinate pentru prevenirea și
tratarea hemoroizilor în mod natural. Datorită prezenței acidului hialuronic și Aloei
Vera, oferă o pelicula protectoare și emolientă, ajutând la restabilirea hidratării și
lubrifierii, eliminând senzațiile incomode. Stimuleaza regenerarea fiziologică a
mucoasei. Prezența extractelor naturale de Ruscus, Hamamelis și Castan oferă o
acțiune calmantă și antioxidantă.
Hemopran Supozitoare protectoare endorectale sunt indicate în tratamentul
hemoroizilor externi și interni precum și a fisurilor anale.
Modul de utilizare și dozaj
Este preferabil, ca pacienții să nu efectueze defecația (dacă este posibil) cel puțin o
oră după administrarea dozei, altfel doza trebuie repetată după defecare.
Adulți: 1 supozitor endorectal seara, 7 zile consecutive sau conform indicațiilor
medicale.
Compoziția: fiecare supozitor endorectal de 2g conține: Ruscus Aculeatus Root
glycolic Extract, Hamamelis Virginiana Leaf glycolic Extract, Aesculus Hippocastanum
Seed glycolic Extract, Aloe Barbadensis Leaf extract, Vitamina E , acid hialuronic,
Grasimi tare (Suppocire BS2X).
Precauții: A nu se lăsa la îndemâna copiilor. Nu înghițiți. A nu se utiliza în caz de
hipersensibilitate sau alergie la unul dintre componente. A nu se utiliza după data
de expirare indicată în partea de jos al ambalajului. Nu utilizați, dacă ambalajul este
deschis și/sau deteriorat. Evitați contactul cu ochii. În caz de contact cu ochii clătiți
cu apă din abundența. Nu depășiți doza recomandată, cu excepția cazului în care
medicul dumneavoastră vă recomandă altfel. A se păstra la loc răcoros și uscat, la o
temperatură sub 250
C.
Contraindicații și efecte secundare
În cercetările științifice actuale nu există dovezi cunoscute, care să contrazică
utilizarea produsului la femei gravide.
Hemopran Supozitoare endorectale protectoare trebuie utilizate sub supravegherea
medicului, în special la pacienții cu boli severe și/sau maligne, și la pacienții cu
sângerare abundente și continue.
Hemopran Supozitoarele endorectale protectoare sunt în general bine tolerate.
Nu se cunosc efecte adverse și contraindicații dacă sunt respectate dozele în mod
rezonabil.
Mărimea: 1 blister conține 7 supozitoare endorectale (2g)
Hemopran Supozitoare protectoare endorectale sunt destinate pentru prevenirea și
tratarea hemoroizilor în mod natural. Datorită prezenței acidului hialuronic și Aloei
Vera, oferă o pelicula protectoare și emolientă, ajutând la restabilirea hidratării și
lubrifierii, eliminând senzațiile incomode. Stimuleaza regenerarea fiziologică a
mucoasei. Prezența extractelor naturale de Ruscus, Hamamelis și Castan oferă o
acțiune calmantă și antioxidantă.
Hemopran Supozitoare protectoare endorectale sunt indicate în tratamentul
hemoroizilor externi și interni precum și a fisurilor anale.
Modul de utilizare și dozaj
Este preferabil, ca pacienții să nu efectueze defecația (dacă este posibil) cel puțin o
oră după administrarea dozei, altfel doza trebuie repetată după defecare.
Adulți: 1 supozitor endorectal seara, 7 zile consecutive sau conform indicațiilor
medicale.
Compoziția: fiecare supozitor endorectal de 2g conține: Ruscus Aculeatus Root
glycolic Extract, Hamamelis Virginiana Leaf glycolic Extract, Aesculus Hippocastanum
Seed glycolic Extract, Aloe Barbadensis Leaf extract, Vitamina E , acid hialuronic,
Grasimi tare (Suppocire BS2X).
Precauții: A nu se lăsa la îndemâna copiilor. Nu înghițiți. A nu se utiliza în caz de
hipersensibilitate sau alergie la unul dintre componente. A nu se utiliza după data
de expirare indicată în partea de jos al ambalajului. Nu utilizați, dacă ambalajul este
deschis și/sau deteriorat. Evitați contactul cu ochii. În caz de contact cu ochii clătiți
cu apă din abundența. Nu depășiți doza recomandată, cu excepția cazului în care
medicul dumneavoastră vă recomandă altfel. A se păstra la loc răcoros și uscat, la o
temperatură sub 250
C.
Contraindicații și efecte secundare
În cercetările științifice actuale nu există dovezi cunoscute, care să contrazică
utilizarea produsului la femei gravide.
Hemopran Supozitoare endorectale protectoare trebuie utilizate sub supravegherea
medicului, în special la pacienții cu boli severe și/sau maligne, și la pacienții cu
sângerare abundente și continue.
Hemopran Supozitoarele endorectale protectoare sunt în general bine tolerate.
Nu se cunosc efecte adverse și contraindicații dacă sunt respectate dozele în mod
rezonabil.
Mărimea: 1 blister conține 7 supozitoare endorectale (2g)
0
În stoc
HEMOpran cremă protectoare endorectală
Este recomandată ca adjuvant în tratamentul sindromului hemoroidal varicos
(hemoroizi interni și externi), iritațiilor, mucoaselor anale și perianale.
Datorită formării unei pelicule protectoare și lubrifiante, previne iritațiile comune
din cauza fricționării, în prezența hemoroizilor, adesea cauzate de constipație,
sedentarism, ortostatism și sarcină. Ameliorează senzațiile de durere, arsură și
mâncărime. Formulat cu extracte naturale cu acțiune liniștitoare și răcoritoare. Nu
conține derivați de cortizon, coloranți și parfumuri sintetizate.
Modul de utilizare și dozaj
Înainte de utilizare Hemopran Crema protectoare endorectală: curățați zona anală și
perianală cu soluții speciale și uscați corespunzător.
Aplicați Hemopran Crema protectoare endorectală: scoateți căpăcelul și după sigiliu
din aluminiu, care deschide tubul, apoi fixați aplicator pe tub. Gentil introduceți
aplicator în anus și ușor apasați tubul pentru a aplica cantitatea dorită de produs.
După utilizare Hemopran Crema protectoare endorectală: scoateți aplicatorul, spălați
corespunzător cu săpun și apă. Închideți tubul cu capac. Aplicatorul este reutilizabil.
Repetați tratamentul de până la 3-4 ori pe zi, până la dispariția simptomelor. Dacă
simptomele persistă, consultați medicul Dvs. Durata tratamentului nu trebuie să
depășească 30 zile. Pentru a preveni iritațiile, datorită fricționării, este recomandat să
utilizați Hemopran Crema protectoare endorectală înainte unei mișcări intestinale.
Compoziția
Hemopran Crema protectoare endorectală este formulată din Aesculus Hippocastanum
glycolic extract, Hamamelis Virginiana glycolic extract, Ruscus Aculeatus glycolic
extract, Aloe Vera foliar gel, Avenanthramide de originea biotehnologică, ulei de
Jojoba.
În plus conține: Ceteareth-20, Cetyl Esters, Phenoxyethanol, Isopropyl Myristate,
Acid Stearic, C12-20 Acid PEG-8 Ester, Menthyl lactat, Carbomer, Glyceryl Stearat SE,
Triethanolamine, Apă.
Precauții
Închideți tubul etanș cu capacul după utilizarea produsului. Spălați aplicatorul după
fiecare utilizare. Nu lăsați la îndemâna copiilor. Nu utilizați pe pielea deteriorată
și pe mucoase. Nu înghițiți. Nu utilizați în caz de hipersensibilitate sau alergii la
ingrediente. Nu utilizați după data de expirare indicată în parte de jos a ambalajului
și pe tub. Nu utilizați produsul dacă cutia a fost deschisă sau deteriorată. Păstrați în
loc răcoros și uscat, la temperatura 40
C – 350
C.
Contraindicații și efecte secundare
Nu sunt cunoscute efecte secundare și contraindicații în condiții normale și previzibile
în mod rezonabil descrise în acest prospect. În cercetările științifice actuale nu există
dovezi cunoscute care să interzică utilizarea produsului la femeile gravide.
Este recomandată ca adjuvant în tratamentul sindromului hemoroidal varicos
(hemoroizi interni și externi), iritațiilor, mucoaselor anale și perianale.
Datorită formării unei pelicule protectoare și lubrifiante, previne iritațiile comune
din cauza fricționării, în prezența hemoroizilor, adesea cauzate de constipație,
sedentarism, ortostatism și sarcină. Ameliorează senzațiile de durere, arsură și
mâncărime. Formulat cu extracte naturale cu acțiune liniștitoare și răcoritoare. Nu
conține derivați de cortizon, coloranți și parfumuri sintetizate.
Modul de utilizare și dozaj
Înainte de utilizare Hemopran Crema protectoare endorectală: curățați zona anală și
perianală cu soluții speciale și uscați corespunzător.
Aplicați Hemopran Crema protectoare endorectală: scoateți căpăcelul și după sigiliu
din aluminiu, care deschide tubul, apoi fixați aplicator pe tub. Gentil introduceți
aplicator în anus și ușor apasați tubul pentru a aplica cantitatea dorită de produs.
După utilizare Hemopran Crema protectoare endorectală: scoateți aplicatorul, spălați
corespunzător cu săpun și apă. Închideți tubul cu capac. Aplicatorul este reutilizabil.
Repetați tratamentul de până la 3-4 ori pe zi, până la dispariția simptomelor. Dacă
simptomele persistă, consultați medicul Dvs. Durata tratamentului nu trebuie să
depășească 30 zile. Pentru a preveni iritațiile, datorită fricționării, este recomandat să
utilizați Hemopran Crema protectoare endorectală înainte unei mișcări intestinale.
Compoziția
Hemopran Crema protectoare endorectală este formulată din Aesculus Hippocastanum
glycolic extract, Hamamelis Virginiana glycolic extract, Ruscus Aculeatus glycolic
extract, Aloe Vera foliar gel, Avenanthramide de originea biotehnologică, ulei de
Jojoba.
În plus conține: Ceteareth-20, Cetyl Esters, Phenoxyethanol, Isopropyl Myristate,
Acid Stearic, C12-20 Acid PEG-8 Ester, Menthyl lactat, Carbomer, Glyceryl Stearat SE,
Triethanolamine, Apă.
Precauții
Închideți tubul etanș cu capacul după utilizarea produsului. Spălați aplicatorul după
fiecare utilizare. Nu lăsați la îndemâna copiilor. Nu utilizați pe pielea deteriorată
și pe mucoase. Nu înghițiți. Nu utilizați în caz de hipersensibilitate sau alergii la
ingrediente. Nu utilizați după data de expirare indicată în parte de jos a ambalajului
și pe tub. Nu utilizați produsul dacă cutia a fost deschisă sau deteriorată. Păstrați în
loc răcoros și uscat, la temperatura 40
C – 350
C.
Contraindicații și efecte secundare
Nu sunt cunoscute efecte secundare și contraindicații în condiții normale și previzibile
în mod rezonabil descrise în acest prospect. În cercetările științifice actuale nu există
dovezi cunoscute care să interzică utilizarea produsului la femeile gravide.
0
Nu este disponibil
Indicaţii terapeutice
Profilaxia şi controlul hemoragiilor de diversă etiologie în capilarele superficiale şi interne, în special
dacă hemoragia este determinată de afectarea endoteliului:
- Chirurgie: prevenirea şi tratamentul hemoragiilor capilare apărute în cursul interventiilor
chirurgicale din ginecologie, obstetrică, ORL, urologie, gastroenterologie.
- Medicina internă: prevenirea şi tratamentul hemoragiilor capilare de diverse etiologii şi
localizări - hematurie, hematemeză, melenă, epistaxis, gingivoragie, hemoragii de natură
medicamentoasă (prin anticoagulante sau AINS).
- Ginecologie: metroragie, menoragie primară sau datorată dispozitivelor intrauterine, de mică
intensitate, în absenţa unei patologii organice.
Doze şi mod de administrare
Preparatul se administrează intravenos (lent) sau intramuscular.
Doze
Adulţi
În caz de urgenţă: 2-3 fiole, de 3 ori pe zi, intravenos sau intramuscular atât cât persistă hemoragia şi
riscul hemoragic.
Preoperator: 1-2 fiole (250-500mg), intravenos sau intramuscular, cu o oră înainte de intervenţie.
Intraoperator: 1-2 fiole intravenos; administrarea acestei doze poate fi repetată.
Postoperator: 1-2 fiole (250-500mg) intravenos sau intramuscular fiecare 4-6 ore până la dispariţia
riscului de hemoragie.
Aplicare topică: se umezește un tampon cu conținutul unei fiole și se aplică pe zona hemoragică sau
în cavitatea după extracția dentară. A se repeta, daca este necesar. Combinație cu administrarea
orală sau parenterală este posibilă.
Copii
Se administrează jumătate din doza recomandată la adulţi.
Pacienți cu insuficiență hepatică sau renală
Nu au fost efectuate studii clinice la pacienţii care prezintă insuficienţă hepatică sau renală. Prin
urmare, este necesară prudenţă atunci cînd soluție injectabilă se administrează la această categorie
de pacienți.
Contraindicaţii
- Hipersensibilitate la etamsilat sau la oricare dintre excipienţii enumerați la pct.6.1;
- Hipersensibilitate dovedita la sulfiți.
- Astm bronşic;
- Porfirie acută;
- Hipercoagulare sanguină, hemoragii, cauzate de administrarea remediilor anticoagulante;
- Hemoblastoză (leucemie limfatică şi mieloidă, osteosarcom) la copii.
- Tratamentul poate fi iniţiat după excluderea formaţiunilor fibroase ale uterului.
https://bit.ly/2R3fxUt
Profilaxia şi controlul hemoragiilor de diversă etiologie în capilarele superficiale şi interne, în special
dacă hemoragia este determinată de afectarea endoteliului:
- Chirurgie: prevenirea şi tratamentul hemoragiilor capilare apărute în cursul interventiilor
chirurgicale din ginecologie, obstetrică, ORL, urologie, gastroenterologie.
- Medicina internă: prevenirea şi tratamentul hemoragiilor capilare de diverse etiologii şi
localizări - hematurie, hematemeză, melenă, epistaxis, gingivoragie, hemoragii de natură
medicamentoasă (prin anticoagulante sau AINS).
- Ginecologie: metroragie, menoragie primară sau datorată dispozitivelor intrauterine, de mică
intensitate, în absenţa unei patologii organice.
Doze şi mod de administrare
Preparatul se administrează intravenos (lent) sau intramuscular.
Doze
Adulţi
În caz de urgenţă: 2-3 fiole, de 3 ori pe zi, intravenos sau intramuscular atât cât persistă hemoragia şi
riscul hemoragic.
Preoperator: 1-2 fiole (250-500mg), intravenos sau intramuscular, cu o oră înainte de intervenţie.
Intraoperator: 1-2 fiole intravenos; administrarea acestei doze poate fi repetată.
Postoperator: 1-2 fiole (250-500mg) intravenos sau intramuscular fiecare 4-6 ore până la dispariţia
riscului de hemoragie.
Aplicare topică: se umezește un tampon cu conținutul unei fiole și se aplică pe zona hemoragică sau
în cavitatea după extracția dentară. A se repeta, daca este necesar. Combinație cu administrarea
orală sau parenterală este posibilă.
Copii
Se administrează jumătate din doza recomandată la adulţi.
Pacienți cu insuficiență hepatică sau renală
Nu au fost efectuate studii clinice la pacienţii care prezintă insuficienţă hepatică sau renală. Prin
urmare, este necesară prudenţă atunci cînd soluție injectabilă se administrează la această categorie
de pacienți.
Contraindicaţii
- Hipersensibilitate la etamsilat sau la oricare dintre excipienţii enumerați la pct.6.1;
- Hipersensibilitate dovedita la sulfiți.
- Astm bronşic;
- Porfirie acută;
- Hipercoagulare sanguină, hemoragii, cauzate de administrarea remediilor anticoagulante;
- Hemoblastoză (leucemie limfatică şi mieloidă, osteosarcom) la copii.
- Tratamentul poate fi iniţiat după excluderea formaţiunilor fibroase ale uterului.
https://bit.ly/2R3fxUt
0
Nu este disponibil
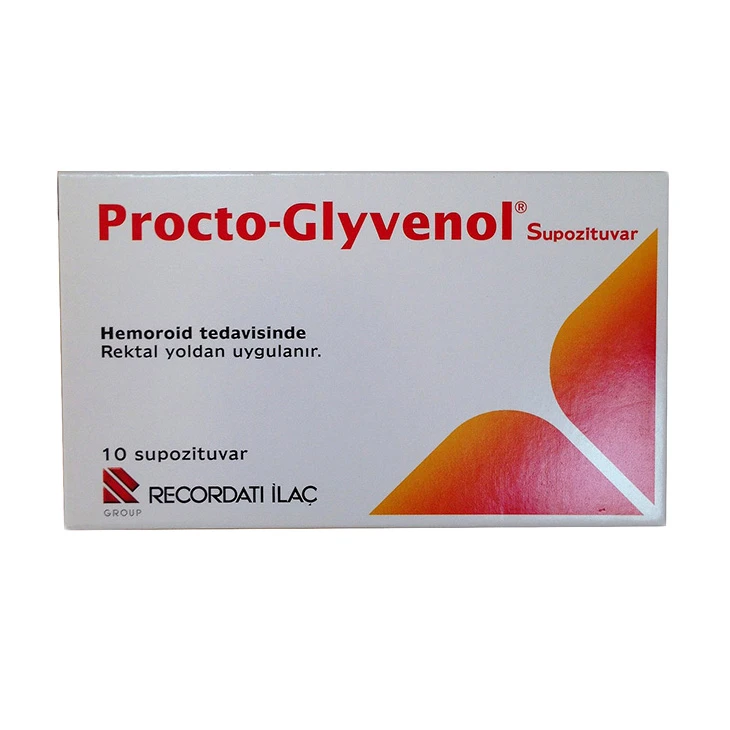
Procto-Glyvenol crema rectala este un medicament care se utilizeaza pentru tratamentul local al hemoroizilor interni si externi.
Ce este Procto-Glyvenol şi pentru ce se utilizează
Substanţele active conţinute în Procto-Glyvenol sunt tribenozidă şi lidocaină.
Procto-Glyvenol este utilizat pentru tratamentul local al hemoroizilor externi şi interni. Hemoroizii sunt inflamaţii ale venelor din zona rectă sau anală care provoacă durere locală, usturime şi mâncărimi.
Tribenozida acţionează local asupra cauzelor inflamaţiei de la nivelul vaselor mici de sânge. Indicații terapeutice
- Procto-Glyvenol cremă rectală se recomandă a fi folosit pentru tratamentul local al hemoroizilor interni și externi.
Contraindicații
- acest medicament nu este recomandat a fi utilizat în situația în care ați dezvoltat hipersensibilitate la substanțele active - este vorba despre lidocaină și tribenozidă - sau la alt element component al său.
Ce este Procto-Glyvenol şi pentru ce se utilizează
Substanţele active conţinute în Procto-Glyvenol sunt tribenozidă şi lidocaină.
Procto-Glyvenol este utilizat pentru tratamentul local al hemoroizilor externi şi interni. Hemoroizii sunt inflamaţii ale venelor din zona rectă sau anală care provoacă durere locală, usturime şi mâncărimi.
Tribenozida acţionează local asupra cauzelor inflamaţiei de la nivelul vaselor mici de sânge. Indicații terapeutice
- Procto-Glyvenol cremă rectală se recomandă a fi folosit pentru tratamentul local al hemoroizilor interni și externi.
Contraindicații
- acest medicament nu este recomandat a fi utilizat în situația în care ați dezvoltat hipersensibilitate la substanțele active - este vorba despre lidocaină și tribenozidă - sau la alt element component al său.
0
Nu este disponibil
INDICAŢII TERAPEUTICE Tromboza hemoroizilor interni şi externi.
DOZE ŞI MOD DE ADMINISTRARE Rectal. După efectuarea procedurilor igienice (golirea intestinului sau clismă evacuatoare) se administrează rectal câte 1 supozitor de 2 ori pe zi. Cura de tratament constituie 10-14 zile.
CONTRAINDICAŢII Hipersensibilitate la componentele preparatului.
https://bit.ly/33ylhIl
DOZE ŞI MOD DE ADMINISTRARE Rectal. După efectuarea procedurilor igienice (golirea intestinului sau clismă evacuatoare) se administrează rectal câte 1 supozitor de 2 ori pe zi. Cura de tratament constituie 10-14 zile.
CONTRAINDICAŢII Hipersensibilitate la componentele preparatului.
https://bit.ly/33ylhIl
0
Nu este disponibil
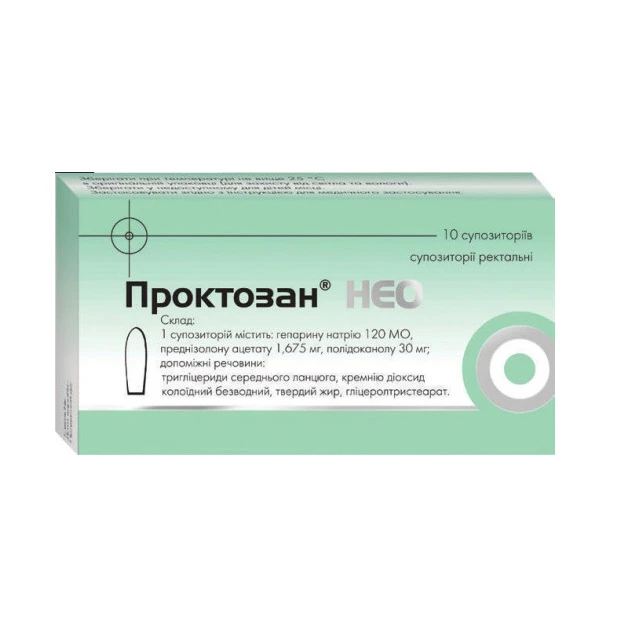
Ce este Proctosan Neo supozitoare şi pentru ce se utilizează
Proctosan Neo supozitoare conține substanțele active: heparină sodică, lauromacrogol 400, prednizolonă. Această combinație este eficientă în tratarea simptomatică a hemoroizilor cum ar fi: pruritul, senzaţia de arsură, înțepături și dureri în regiunea anorectală. Datorită heparinei din compponența sa Proctosan Neo supozitoare preintâmpină formarea trombilor în nodulii hemoroidali, prednizolona înlătură inflamația, lauromacrogol 400 are efect analgezic local și înlătură pruritul.
Proctosan Neo supozitoare se indică pentru tratarea simptomatică a hemoroizilor și pruritului în regiunea anorectală pe o perioadă scurtă de timp. Cum să utilizaţi Proctosan Neo supozitoare
Utilizaţi întotdeauna Proctosan Neo supozitoare exact aşa cum v-a spus medicul dumneavoastră. Trebuie să discutaţi cu medicul dumneavoastră sau cu farmacistul dacă nu sunteţi sigur.
Cum se utilizează supozitoarele:
- Supozitoarele se administrează rectal după defecaţie.
- Spălați-vă pe mâini.
- Îndepărtaţi folia protectoare.
- Culcați-vă pe o parte cu genunchii spre piept. Întroduceți supozitorul în rect. Rămâneți în această poziție următoarele câteva minute.
- Dacă simțiți că supozitorul iese înapoi atunci strângeți fesele. Este important de a ține supozitorul intrarectal până la absorbția totală a substanțelor.
Raportarea reacţiilor adverse
Dacă manifestaţi orice reacţii adverse, adresaţi-vă medicului dumneavoastră sau farmacistului.
Proctosan Neo supozitoare conține substanțele active: heparină sodică, lauromacrogol 400, prednizolonă. Această combinație este eficientă în tratarea simptomatică a hemoroizilor cum ar fi: pruritul, senzaţia de arsură, înțepături și dureri în regiunea anorectală. Datorită heparinei din compponența sa Proctosan Neo supozitoare preintâmpină formarea trombilor în nodulii hemoroidali, prednizolona înlătură inflamația, lauromacrogol 400 are efect analgezic local și înlătură pruritul.
Proctosan Neo supozitoare se indică pentru tratarea simptomatică a hemoroizilor și pruritului în regiunea anorectală pe o perioadă scurtă de timp. Cum să utilizaţi Proctosan Neo supozitoare
Utilizaţi întotdeauna Proctosan Neo supozitoare exact aşa cum v-a spus medicul dumneavoastră. Trebuie să discutaţi cu medicul dumneavoastră sau cu farmacistul dacă nu sunteţi sigur.
Cum se utilizează supozitoarele:
- Supozitoarele se administrează rectal după defecaţie.
- Spălați-vă pe mâini.
- Îndepărtaţi folia protectoare.
- Culcați-vă pe o parte cu genunchii spre piept. Întroduceți supozitorul în rect. Rămâneți în această poziție următoarele câteva minute.
- Dacă simțiți că supozitorul iese înapoi atunci strângeți fesele. Este important de a ține supozitorul intrarectal până la absorbția totală a substanțelor.
Raportarea reacţiilor adverse
Dacă manifestaţi orice reacţii adverse, adresaţi-vă medicului dumneavoastră sau farmacistului.
0
Nu este disponibil
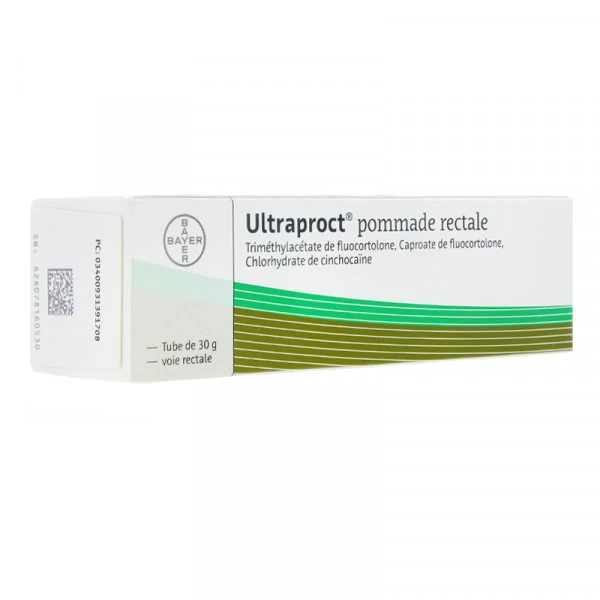
Ce este Ultraproct unguent rectal şi pentru ce se utilizează Ultraproct unguent rectal conţine o substanţă activă care reduce inflamaţia (fluocortolonă) şi un anestezic local (cincocaină) care îndepărtează durerea. Acest medicament este utilizat pentru îndepărtarea inflamaţiei, tumefacţiei, pruritului (mâncărimii), a durerilor provocate de hemoroizi şi pentru a calma mâncărimea anusului (partea terminală) Ultraproct unguent rectal este utilizat pentru tratament de scurtă durată.
Cum să utilizaţi Ultraproct unguent rectal Utilizaţi întotdeauna acest medicament exact aşa cum este descris în acest prospect sau aşa cum v-a spus medicul dumneavoastră. Discutaţi cu medicul dumneavoastră sau cu farmacistul dacă nu sunteţi sigur. Cum se utilizează Ultraproct unguent rectal: 1. Înainte de a utiliza unguentul, spălaţi bine şi apoi uscaţi zona anală şi pielea din jur 2. Dacă unguentul se utilizează pentru aria din jurul anusului: - puneţi o cantitate mică (de mărimea unui bob de mazăre în vârful degetului) - aplicaţi uşor pe piele şi în interiorul anusului 3. Dacă unguentul se utilizează pentru interiorul anusului: - puneţi aplicatorul pe tub - strângeţi tubul până când aplicatorul este plin de unguent - introduceţi foarte uşor aplicatorul în anus pînă când acesta a fost introdus total - apoi, strângeţi tubul şi retrageţi aplicatorul - spălaţi aplicatorul cu apă fierbinte şi săpun şi uscaţi. În general, unguentul trebuie aplicat de cel puţin două ori pe zi, dar pentru a obţine o vindecare mai rapidă în prima zi, acesta se poate aplica de trei sau patru ori. Înainte să aplicați unguentul în interiorul anusului, înșurubați complet aplicatorul pe tub și inserați-l în anus. O cantitate mică de unguent poate să fie apoi introdusă rectal prin strângerea ușoară a tubului. După fiecare aplicare, ștergeți exteriorul aplicatorului cu un șervețel de hârtie, apoi îndepărtați produsul rămas în interiorul aplicatorului cu ajutorul unui bețișor cu vată și ștergeți-l din nou cu un șervețel de hârtie. Clătiți aplicatorul cu apă caldă pentru aproximativ 1 minut și uscați exteriorul aplicatorului cu un șervețel de hârtie.
Reacţii adverse posibile Ca toate medicamentele, acest medicament poate provoca reacţii adverse, cu toate că nu apar la toate persoanele. Poate să apară atrofierea tegumentului dacă Ultraproct unguent rectal este utilizat timp îndelungat. În cazuri rare pot apărea reacţii alergice cutanate. Poate să apară atrofierea tegumentului.
Cum să utilizaţi Ultraproct unguent rectal Utilizaţi întotdeauna acest medicament exact aşa cum este descris în acest prospect sau aşa cum v-a spus medicul dumneavoastră. Discutaţi cu medicul dumneavoastră sau cu farmacistul dacă nu sunteţi sigur. Cum se utilizează Ultraproct unguent rectal: 1. Înainte de a utiliza unguentul, spălaţi bine şi apoi uscaţi zona anală şi pielea din jur 2. Dacă unguentul se utilizează pentru aria din jurul anusului: - puneţi o cantitate mică (de mărimea unui bob de mazăre în vârful degetului) - aplicaţi uşor pe piele şi în interiorul anusului 3. Dacă unguentul se utilizează pentru interiorul anusului: - puneţi aplicatorul pe tub - strângeţi tubul până când aplicatorul este plin de unguent - introduceţi foarte uşor aplicatorul în anus pînă când acesta a fost introdus total - apoi, strângeţi tubul şi retrageţi aplicatorul - spălaţi aplicatorul cu apă fierbinte şi săpun şi uscaţi. În general, unguentul trebuie aplicat de cel puţin două ori pe zi, dar pentru a obţine o vindecare mai rapidă în prima zi, acesta se poate aplica de trei sau patru ori. Înainte să aplicați unguentul în interiorul anusului, înșurubați complet aplicatorul pe tub și inserați-l în anus. O cantitate mică de unguent poate să fie apoi introdusă rectal prin strângerea ușoară a tubului. După fiecare aplicare, ștergeți exteriorul aplicatorului cu un șervețel de hârtie, apoi îndepărtați produsul rămas în interiorul aplicatorului cu ajutorul unui bețișor cu vată și ștergeți-l din nou cu un șervețel de hârtie. Clătiți aplicatorul cu apă caldă pentru aproximativ 1 minut și uscați exteriorul aplicatorului cu un șervețel de hârtie.
Reacţii adverse posibile Ca toate medicamentele, acest medicament poate provoca reacţii adverse, cu toate că nu apar la toate persoanele. Poate să apară atrofierea tegumentului dacă Ultraproct unguent rectal este utilizat timp îndelungat. În cazuri rare pot apărea reacţii alergice cutanate. Poate să apară atrofierea tegumentului.
0
Nu este disponibil
Indicaţii
Hemoroizii interni şi externi.
Utilizare terapeutică
Câte 1 supozitor de 4 ori pe zi (inclusiv şi după scaun). Durata tratamentului nu este limitată. Dacă în 7 zile nu se constată evoluţie pozitivă, trebuie consultat medicul.
Supradozare
Hipercoagulare sanguină.
Efecte adverse
Prurit anal.
Contraindicaţii
Hipersensibilitatea la preparat, tromboemboliile, granulocitopenia.
Hemoroizii interni şi externi.
Utilizare terapeutică
Câte 1 supozitor de 4 ori pe zi (inclusiv şi după scaun). Durata tratamentului nu este limitată. Dacă în 7 zile nu se constată evoluţie pozitivă, trebuie consultat medicul.
Supradozare
Hipercoagulare sanguină.
Efecte adverse
Prurit anal.
Contraindicaţii
Hipersensibilitatea la preparat, tromboemboliile, granulocitopenia.
0
Nu este disponibil
4.1 Indicaţii terapeutice
Aprotinina este indicată pentru uz profilactic în scopul scăderii hemoragiei şi a necesităţii
transfuziilor de sânge, numai pentru pacienţii adulţi care prezintă risc crescut de hemoragie majoră,
cărora li se efectuează o intervenţie izolată de by-pass cardiopulmonar (adică intervenţie de by-pass
aorto-coronarian neasociată unei alte intervenţii cardiovasculare).
Aprotinina trebuie utilizată numai după o evaluare atentă a beneficiilor și riscurilor, precum și
luarea în considerare că sunt disponibile tratamente alternative (vezi pct 4.4 și 5.1).
4.2 Doze şi mod de administrare
Doze
Înaintea iniţierii tratamentului la toţi pacienţii este necesară efectuarea testului la anticorpi IgG,
specifici la aprotinină (vezi pct 4.3).
Adulți
Din cauza riscului apariţiei unor reacţii alergice/anafilactice, tuturor pacienţilor trebuie să li se
administreze o doză test de 1 ml (10000 UIK), cu cel puţin 10 minute înainte de administrarea
cantităţii rămase din doză. După administrarea fără evenimente a dozei test de 1ml, poate fi
administrată doza terapeutică. Cu 15 minute înainte de administrarea dozei test de aprotinină poate
fi administrat un medicament antagonist H1 şi un medicament antagonist H2. În orice caz, trebuie să
fie imediat disponibile tratamente standard de urgenţă pentru reacţii anafilactice şi alergice (vezi
pct.4.4).
O doză de încărcare de 1-2 milioane UIK se administrează sub formă de injecţie intravenoasă sau
perfuzie timp de 20-30 minute de la inducţia anesteziei şi înaintea sternotomiei. O cantitate
suplimentară de 1-2 milioane UIK trebuie adăugată în amorsa pompei aparatului de by-pass cardiopulmonar. Pentru a evita incompatibilitatea fizică a aprotininei şi heparinei, la adăugarea soluţiei de
amorsare a pompei, fiecare medicament trebuie adăugat în timpul recirculării amorsei pompei,
pentru a se asigura diluarea adecvată înainte de amestecarea cu cealaltă componentă. Perfuzia în
bolus iniţială este urmată de administrarea unei perfuzii continue de 250000-500000 UIK pe oră,
2
până la sfârşitul intervenţiei chirurgicale.
În general, cantitatea totală de aprotinină administrată într-o cură de tratament nu trebuie să
depăşească 7 milioane UIK.
Copii și adolescenți
Nu au fost stabilite siguranța și eficacitatea aprotininei la copii sub 18 ani.
Insuficiență renală
Experiențele clinice disponibile sugerează că pacienții cu insuficiență renală scăzută nu necesită
ajustarea dozei specială.
Insuficiență hepatică
Nu există date disponibile cu privire la recomandările de dozaj la pacienții cu insuficiență hepatică.
Vârstnici
Experiența clinică nu a menţionat nici o reacţie specifică la preparat la pacienții vârstnici.
Mod de administrare
Aprotinina pentru administrare intravenoasă trebuie administrată printr-un cateter venos central,
care nu se utilizează pentru administrarea altor preparate. Când se folosește un cateter central multilumen, atunci nu este necesară utilizarea unui cateter separat.
Aprotinina trebuie administrată numai pacienților în poziția culcat pe spate și se va administra lent
(viteza maximă - 5-10 ml pe minut) intravenos sau în perfuzie intravenoasă de scurtă durată.
4.3 Contraindicaţii
Hipersensibilitate la substanța activă sau la oricare dintre excipienții enumerați la pct. 6.1
La pacienţii cu anticorpi IgG, specifici la aprotinină, în tratamentul cu aprotinină se înregistrează un
risc crescut de anafilaxie. Tratamentul cu aprotinină pentru astfel de pacienţi este contraindicat.
Dacă efectuarea testului la anticorpi IgG specifici contra aprotininei înaintea iniţierii tratamentului
este imposibilă, dar se presupune, că pacientul a primit tratament cu aprotinină în ultimele 12 luni,
administrarea aprotininei este contraindicată.
4.4 Atenţionări şi precauţii speciale pentru utilizare
Aprotinina nu trebuie utilizată atunci când intervenţia de BAC este asociată cu o altă intervenţie
cardiovasculară, deoarece raportul risc-beneficiu pentru utilizarea aprotininei în cazul altor
proceduri cardiovasculare nu a fost stabilit.
Monitorizarea în laborator a anticoagulării în timpul bypass-ului cardiopulmonar
Aprotinina nu este un medicament care reduce consumul de heparină, fiind importantă menţinerea
anticoagulării adecvate cu heparină pe durata terapiei cu aprotinină. Sunt de aşteptat creşteri ale
valorilor timpului parţial de tromboplastină (APTT) şi ale timpului de coagulare activat de celite
(Celite ACT) la pacienţii trataţi cu aprotinină, în timpul intervenţiei chirurgicale şi în orele de după
aceasta. Prin urmare, în vederea menţinerii anticoagulării adecvate cu heparină nu trebuie
utilizat ca indicator timpul parţial de tromboplastină (APTT). La pacienţii cărora li se
efectuează bypass-ul cardiopulmonar în asociere cu tratament cu aprotinină, se recomandă
una dintre următoarele trei metode pentru monitorizarea anticoagulării adecvate: timpul de
coagulare activat (ACT), dozarea fixă de heparină sau titrarea heparinei (vezi mai jos). Dacă
se utilizează timpul de coagulare activat (ACT) pentru monitorizarea anticoagulării adecvate,
3
se recomandă o valoare a celite ACT de minim 750 secunde sau a caolin ACT de minim 480
secunde, în prezenţa aprotininei, indiferent de efectele hemodiluţiei şi hipotermiei.
Notă suplimentară privind circulaţia extracorporală
La pacienţii cărora li se efectuează bypass-ul cardiopulmonar în asociere cu tratament cu aprotinină,
se recomandă una dintre următoarele metode pentru monitorizare anticoagulării adecvate:
• Timpul de coagulare activat (ACT)
ACT nu este un test de coagulare standardizat, iar diferitele formule de testare sunt influenţate de
prezenţa aprotininei. Testul mai este influenţat de efectele diluţiei variabile şi de temperatura din
timpul bypass-ului cardiopulmonar. S-aobservat că aprotinina nu determină creşterea valorilor
rezultatelor la testele ACT pe bază de caolin în aceeaşi măsură comparativ cu testele ACT pe bază
de pământ diatomaceu (celite). Deşi protocoalele variază, în prezenţa aprotininei se recomandă o
valoare acelite ACT de minim 750 secunde sau acaolin ACTde minim 480 secunde, indiferent de
efectele hemodiluţiei şi hipotermiei. Consultaţi producătorul testului ACT cu privire la interpretarea
rezultatelor testării în prezenţa aprotininei.
• Dozare fixă de heparină
Doza standard de încărcare cu heparină, administrată înainte de cateterizarea cordului, plus
cantitatea de heparină adăugată la volumul amorsei din circuitul bypass-ului cardiopulmonar trebuie
să reprezinte în total cel puţin 350 UI/kg. Trebuie să se administreze o cantitate suplimentară de
heparină într-o schemă de dozaj cu doză fixă, în funcţie de greutatea pacientului şi durata
intervenţiei chirurgicale de bypass cardiopulmonar.
• Determinarea concentraţiilor de heparină
Dozarea protaminei, o metodă care nu este afectată de aprotinină, poate fi utilizată pentru măsurarea
concentraţiilor de heparină. Trebuie să se determine răspunsul la doza de heparină, evaluat prin
dozarea protaminei, înainte de administrarea aprotininei, pentru a determina doza de încărcare cu
heparină. Se administrează suplimentar heparină pe baza concentraţiilor de heparină măsurate prin
dozarea protaminei. Nu trebuie permisă scăderea concentraţiilor de heparină sub 2,7 U/ml (2,0
mg/kg) sau sub concentraţia indicată la testarea răspunsului la doza de heparină efectuată înainte de
administrarea aprotininei.
La pacienţii trataţi cu aprotinină, neutralizarea heparinei cu protamină după încheierea bypass-ului
cardiopulmonar fie trebuie să se bazeze pe un raport fix faţă de cantitatea de heparină administrată,
fie să fie controlată printr-o metodă de dozare a protaminei.
Important: aprotinina nu este un medicament care reduce consumul de heparină
Conservarea grefonului
Sângele recoltat prin cateterul central folosit pentru administrarea aprotininei nu trebuie utilizat
pentru conservarea grefonului.
Expunerea repetată la aprotinină
Administrarea de aprotinină, în special la pacienţii la care s-a administrat anterior aprotinină
(inclusiv aprotinină din produsele care conţin substanţe de legare a fibrinei) necesită o evaluare
risc/beneficiu atentă, deoarece poate apărea o reacţie alergică (vezi pct.4.3 şi 4.8). Deşi majoritatea
cazurilor de anafilaxie apar în cazul repetării expunerii în primele 12 luni, există şi raportări de
cazuri unice de anafilaxie care au apărut la repetarea expunerii după mai mult de 12 luni.
Tratament standard de urgenţă pentru reacţii alergice/anafilactice trebuie să fie disponibil în timpul
tratamentului cu aprotinină.
4
Evaluarea potenţialului de reacţii alergice
Tuturor pacienţilor trataţi cu aprotinină trebuie să li se administreze mai întâi o doză de test, pentru
a evalua posibilitatea unor reacţii alergice (vezi pct.4.2). Doza de test de aprotinină se administrează
numai când sunt disponibile la faţa locului facilităţi şi echipamente pentru gestionarea reacţiilor
anafilactice acute.
Insuficienţă renală
Rezultatele din studii observaţionale recente indică faptul că aprotinina poate determina disfuncţie
renală, în special la pacienţii cu disfuncţie renală preexistentă. O analiză globală a tuturor studiilor
placebo controlate la pacienţi cărora li s-a efectuat o intervenţie chirurgicală de bypass aortocoronarian (BAC) a indicat creşteri ale valorilor serice ale creatininei >0.5 mg/dl peste valoarea de
la momentul iniţial la pacienţii trataţi cu aprotinină (vezi pct.5.1). Prin urmare, se recomandă
evaluarea cu atenţie a profilului risc– beneficiu înainte de administrarea aprotininei la pacienţii cu
modificări ale funcţiei renale sau la cei cu factori de risc (cum este tratamentul concomitent cu
aminoglicozide).
La pacienţii cărora li s-a efectuat o intervenţie chirurgicală de bypass cardiopulmonar cu stop
circulator hipotermic profund în timpul intervenţiei la nivelul aortei toracice, trataţi cu aprotinină, sa raportat o creştere a incidenţei insuficienţei renale şi a mortalităţii comparativ cu grupul de control
cu vârste corespunzătoare, obţinut din date anterioare. Trebuie asigurată anticoagularea adecvată cu
heparină (vezi, de asemenea, mai sus).
Mortalitate
Informaţiile privind mortalitatea obţinute din studiile clinice randomizate sunt furnizate la pct.5.1.
S-a raportat o asociere între utilizarea aprotininei şi mortalitate crescută în unele studii
observaţionale nerandomizate (de ex. Mangano 2007, Schneeweiss 2008, Olenchock 2008, Shaw
2008) ,în timp ce alte studii nerandomizate nu au raportat o astfel de asociere (de ex. Karkouti
2006, Mangano 2006, Coleman 2007, Pagano 2008, Ngaage 2008, Karkouti 2009). În aceste studii,
aprotinina s-a administrat de obicei pacienţilor care prezent au mai mulţi factori de risc pentru
mortalitate crescută înaintea intervenţiei chirurgicale decât pacienţilor din alte grupuri de tratament.
Cele mai multe dintre studii nu au ţinut cont în mod adecvat de aceste diferenţe, cu privire la
factorii de risc, la momentul iniţial, iar influenţa acestor factori de risc asupra rezultatelor nu este
cunoscută. Prin urmare, interpretarea acestor studii observaţionale este limitată, iar asocierea dintre
utilizarea aprotininei şi mortalitatea crescută nu poate fi stabilită sau respinsă. De aceea, aprotinina
trebuie utilizată numai în situaţiile pentru care a fost autorizată, în cazuri izolate de intervenţie
chirurgicală BAC, după evaluarea cu atenţie a potenţialelor riscuri şi beneficii.
Un studiu publicat de Fergusson et al 2008 a analizat datele dintr-un studiu controlat randomizat,
”Blood Conservation Using Antifibrinolytic sin a Randomized Trial” (BART) şi a raportat o rată
mai ridicată a mortalităţii la pacienţii trataţi cu aprotinină comparativ cu cei trataţi cu acid
tranexamic sau acid aminocaproic. Totuşi, datorită mai multor deficienţe ale metodei, nu se poate
concluziona cu privire la riscurile cardiovasculare obţinute din studiul BART.
Excipienți
Gordox soluție injectabilă conține benzil-alcool. Benzil-alcoolul poate provoca reacții anafilactiode.
Gordox soluție injectabilă conține sodiu 1,45 mmol (33,42 mg) per doză. A se lua în considerație de
către pacienții care sunt la o dietă hiposodică.
4.5 Interacţiuni cu alte medicamente şi alte forme de interacţiune
Aprotinina are un efect inhibitor dependent de doză asupra acţiunii medicamentelor trombolitice, de
exemplu streptokinază, urokinază, alteplază (r-tPA).
5
Aprotinina poate declanşa insuficienţa renală, în special la pacienţii cu modificări preexistente ale
funcţiei renale. Aminoglicozidele reprezintă un factor de risc pentru apariţia insuficienţei renale.
4.6 Fertilitatea, sarcina şi alăptarea
Sarcina
Nu există studii adecvate şi bine controlate efectuate la femeile gravide.
Studiile la animale nu au furnizat dovezi privind efecte teratogene sau embriotoxice în cazul
aprotininei. Aprotinina trebuie utilizată în timpul sarcinii doar dacă raportul risc-beneficiu este
favorabil. În caz de reacţii adverse severe la medicament (cum sunt reacţia anafilactică, stopul
cardiac, etc.) şi al măsurilor terapeutice consecutive, la evaluarea raportului risc/beneficiu, trebuie
să se ia în vedere efectele adverse ale acestora asupra fetuşilor.
Alăptarea
Nu se cunoaşte dacă aprotinina se excretă în laptele uman. Totuşi, deoarece aprotinina nu este
biodisponibilă după administrarea orală, orice cantitate din medicament prezentă în lapte nu se
preconizează a avea un efect sistemic asupra copilului alăptat.
Fertilitatea
Nu există studii adecvate şi bine controlate asupra fertilităţii la bărbaţi sau femei.
4.7 Efecte asupra capacităţii de a conduce vehicule şi de a folosi utilaje
Nu sunt relevante.
4.8 Reacţii adverse
Rezumatul profilului de siguranță
Siguranţa aprotininei a fost evaluată în mai mult de patruzeci şi cinci de studii de fază II şi fază III,
care au inclus peste 3800 pacienţi cărora li s-a administrat aprotinină. În total, aproximativ 11%
dintre pacienţii trataţi cu aprotinină au prezentat reacţii adverse. Cea mai gravă reacţie adversă a
fost infarctul miocardic. Reacţiile adverse trebuie interpretate în contextul intervenţiilor
chirurgicale.
Reacţiile alergice/anafilactice sunt rare la pacienţii cărora nu li s-a administrat anterior aprotinină.
În cazul expunerii repetate, incidenţa reacţiilor alergice/anafilactice poate atinge frecvenţa de 5%. O
analiză retrospectivă a indicat că incidenţa unei reacţii alergice/anafilactice în urma expunerii
repetate este crescută în cazul în care expunerea repetată survine în interval de 6 luni de la
administrarea iniţială(5% pentru expunerea repetată în interval de 6 luni şi 0,9 % pentru expunerea
repetată la mai mult de 6 luni). O analiză retrospectivă sugerează că incidenţa reacţiilor anafilactice
severe la aprotinină poate creşte şi mai mult când pacienţii sunt expuşi repetat de mai mult de două
ori în interval de 6 luni. Chiar şi în cazul în care o a doua expunere la aprotinină a fost tolerată fără
7
simptome, o administrare ulterioară poate conduce la reacţii alergice severe sau la şoc anafilactic,
cu rezultat fatal, în cazuri foarte rare.
Simptomele reacţiilor alergice/anafilactice pot include:
Sistemul respirator: astm (bronhospasm)
Sistemul cardiovascular: hipotensiune arterială
Piele şi anexe cutanate: prurit, erupţie cutanată tranzitorie, urticarie
Sistemul digestiv: greaţă
Dacă apar reacţii alergice în timpul injecţiei sau perfuziei, administrarea trebuie oprită imediat.
Poate fi necesar tratament standard de urgenţă, respectiv administrarea de adrenalină/epinefrină,
reechilibrare volemică şi administrarea de corticosteroizi.
Sistemul cardiovascular
În cadrul analizei globale a tuturor studiilor clinice placebo controlate, incidenţa infarctului
miocardic (IM) raportat de investigator la pacienţii trataţi cu aprotinină a fost de 5,8% comparativ
cu 4,8% la pacienţii la care s-a administrat placebo, diferenţa dintre grupuri fiind de 0,98%
(aprotinina n=3817 şi placebo n=2682;status: Aprilie 2005).
În unele studii a fost observată o tendinţă de incidenţă crescută a IM în asociere cu aprotinina, în
timp ce alte studii au evidenţiat o incidenţă mai scăzută comparativ cu placebo.
Mortalitate
Pentru informaţiile cu privire la riscul de mortalitate asociat cu utilizarea aprotininei, vezi pct.4.4.
Raportarea reacțiilor adverse suspectate
Raportarea reacțiilor adverse suspectate după autorizarea medicamentului este importantă. Aceasta
permite monitorizarea în continuare a raportului beneficiu/risc al medicamentului. Profesioniștii din
domeniul sănătății sunt rugați să raporteze orice reacții adverse suspectate, prin intermediul
sistemului național de raportare disponibil pe site-ul oficial al Agenţiei Medicamentului şi
Dispozitivelor Medicale la următoarea adresă web: www.amed.md sau e-mail:
[email protected]
4.9 Supradozaj
Nu există un antidot specific.
5. PROPRIETĂŢI FARMACOLOGICE
5.1 Proprietăţi farmacodinamice
Grupa farmacoterapeutică: Antihemoragice, inhibitori de proteinază, codul ATC: B02AB01
Aprotinina este un inhibitor de protează cu spectru larg, cu proprietăţi antifibrinolitice. Prin
formarea de complexe inhibitoare enzimatice, stoechiometric reversibile, aprotinina acţionează ca
inhibitor pentru tripsina, plasmina, kalikreina plasmatică şi kalikreina tisulară umane, inhibând
astfel fibrinoliza. Aceasta inhibă, de asemenea, activarea coagulării în faza de contact, care iniţiază
coagularea şi promovează fibrinoliza.
Datele provenind dintr-o analiză globală a studiilor placebo controlate la pacienţi cărora li s-a
efectuat o intervenţie chirurgicală de bypass aorto-coronarian (BAC) au indicat că incidenţa
creşterilor valorilor serice ale creatininei >0.5mg/dl peste valorile premergătoare tratamentului a
fost mai crescută din punct de vedere statistic, la valoarea de 9,0% (185/2047) la grupul la care s-a
administrat doza completă de aprotinină, comparativ cu 6,6% (129/1957) la grupul la care s-a
8
administrat placebo, cu un risc relativ de 1,41 (1,12-1,79). În majoritatea cazurilor, disfuncţia renală
post-operatorie nu a fost severă, fiind reversibilă. Incidenţa creşterii valorilor serice ale creatininei
>2.0mg/dl peste valoarea de la momentul iniţial a fost similară (1,1% față de0,8%) atât la grupul la
care s-a administrat doza completă de aprotinină, cât şi la grupul la care s-a administrat placebo, cu
un risc relativ de 1,16 (0,73-1,85) (vezi pct.4.4)
5.2 Proprietăţi farmacocinetice
Absorbție, distribuție
După injecţia intravenoasă, are loc distribuţia rapidă a aprotininei în spaţiul extracelular, ceea ce
duce la o scădere iniţială a concentraţiei plasmatice de aprotinină, cu un timp de înjumătăţire de
0,3-0,7 ore. La momente ulterioare administrării (adică după 5 ore de la administrarea dozei) timpul
de înjumătăţire plasmatică prin eliminare este de aproximativ 5-10 ore.
Se pare că bariera feto-placentară nu este complet impermeabilă pentru aprotinină, însă traversarea
acestei bariere pare să se facă lent.
Metabolizare, eliminare
Molecula de aprotinină este metabolizată în peptide mai scurte sau aminoacizi, prin activitatea
lizozomală din rinichi. La bărbaţi, excreţia urinară de aprotinină activă reprezintă mai puţin de 5%
din doză. După administrarea injecţiilor cu 131I-aprotinină, la voluntari sănătoşi, 25-40% din
substanţa marcată s-a excretat sub formă de metaboliţi în urină în intervalul de 48 ore de la
administrare. Aceşti metaboliţi nu mai prezentau activitate inhibatoare enzimatică.
Nu sunt disponibile studii de farmacocinetică la pacienţi cu insuficienţă renală stadiul terminal.
Studiile la pacienţi cu insuficienţă renală nu au evidenţiat modificări ale farmacocineticii
semnificative din punct de vedere clinic sau reacţii adverse evidente. Nu se recomandă o ajustare a
dozei.
5.3 Date preclinice de siguranţă
Toxicitatea acută
La şobolani, porcuşori de guineea, iepuri şi câini, administrarea de doze mari (>150.000UIK/kg)
prin injectare rapidă a determinat o scădere a tensiunii arteriale de diferite magnitudini, care s-a
ameliorat rapid.
Toxicitatea asupra funcţiei de reproducere
În studiile la şobolani, dozele zilnice de până la 80000UIK/kg administrate intravenos nu au
determinat toxicitate maternă, embriotoxicitate sau fetotoxicitate. Administrarea de doze zilnice de
până la 100000 UIK/kg nu a afectat creşterea şi dezvoltarea puilor,iar dozele de 200000 UIK/kg şi
9
zi nu au avut efect teratogen. La iepuri, dozele zilnice de 100000UIK/kg administrate intravenos nu
au evidenţiat toxicitate maternă, embriotoxicitate, fetotoxicitate sau teratogenitate.
Potenţialul mutagen
Aprotinina a prezentat un răspuns mutagen negativ la testarea sistemului de deteriorare a ADN cu
Salmonella/microzom şi B.subtilis.
6. PROPRIETĂŢI FARMACEUTICE
6.1 Lista excipienţilor
clorură de sodiu,
alcool benzilic,
hidroxid de sodiu,
acid clorhidric,
apă distilată pentru preparate injectabile.
6.2 Incompatibilităţi
Aprotinina practic este incompatibilă cu alte preparate. Nu se administrează în perfuzii mixte. La
necesitate, se poate dizolva în soluţie de clorură de sodiu 0,9% sau cel puţin în 500 ml de soluţie de
glucoză 5%. Preparatul, dizolvat în glucoză, trebuie administrat în decurs de 4 ore.
Din cauza incompatibilităţii chimice, nu se administrează concomitent cu corticosteroizi, soluţii
pentru alimentaţie parenterală, care conţin aminoacizi şi grăsimi.
6.3 Perioada de valabilitate
60 luni
6.4 Precauţii speciale pentru păstrare
A se păstra la temperaturi sub 30°C. A se păstra în ambalajul original, pentru a fi protejat de lumină.
Dacă conținutul fiolei este tulbure, ea nu trebuie administrată. Fiolele deschise trebuie utilizate
imediat.
6.5 Natura şi conţinutul ambalajului
10 ml soluție în fiole transparente, OPC- cu punct de rupere.
25 fiole OPC cu punct de rupere, pe tavă de plastic, în cutie de carton împreună cu instrucțiunea
pentru utilizator.
6.6 Precauţii speciale pentru eliminarea reziduurilor şi alte instrucţiuni de manipulare
Medicamentele administrate parenteral trebuie inspectate vizual pentru evidențierea de particule și
schimbarea culorii înainte de administrare. Orice soluție reziduală nu trebuie să fie păstrată pentru o
ulterioară utilizare.
Orice produs neutilizat sau material rezidual trebuie eliminat în conformitate cu reglementările
locale.
Medicamentul face obiectul prescripției medicale limitate pentru utilizare în condițiile stabilite de
furnizorii de asistență medicală care oferă asistență medicală specializată în ambulatoriu sau spital.
Aprotinina este indicată pentru uz profilactic în scopul scăderii hemoragiei şi a necesităţii
transfuziilor de sânge, numai pentru pacienţii adulţi care prezintă risc crescut de hemoragie majoră,
cărora li se efectuează o intervenţie izolată de by-pass cardiopulmonar (adică intervenţie de by-pass
aorto-coronarian neasociată unei alte intervenţii cardiovasculare).
Aprotinina trebuie utilizată numai după o evaluare atentă a beneficiilor și riscurilor, precum și
luarea în considerare că sunt disponibile tratamente alternative (vezi pct 4.4 și 5.1).
4.2 Doze şi mod de administrare
Doze
Înaintea iniţierii tratamentului la toţi pacienţii este necesară efectuarea testului la anticorpi IgG,
specifici la aprotinină (vezi pct 4.3).
Adulți
Din cauza riscului apariţiei unor reacţii alergice/anafilactice, tuturor pacienţilor trebuie să li se
administreze o doză test de 1 ml (10000 UIK), cu cel puţin 10 minute înainte de administrarea
cantităţii rămase din doză. După administrarea fără evenimente a dozei test de 1ml, poate fi
administrată doza terapeutică. Cu 15 minute înainte de administrarea dozei test de aprotinină poate
fi administrat un medicament antagonist H1 şi un medicament antagonist H2. În orice caz, trebuie să
fie imediat disponibile tratamente standard de urgenţă pentru reacţii anafilactice şi alergice (vezi
pct.4.4).
O doză de încărcare de 1-2 milioane UIK se administrează sub formă de injecţie intravenoasă sau
perfuzie timp de 20-30 minute de la inducţia anesteziei şi înaintea sternotomiei. O cantitate
suplimentară de 1-2 milioane UIK trebuie adăugată în amorsa pompei aparatului de by-pass cardiopulmonar. Pentru a evita incompatibilitatea fizică a aprotininei şi heparinei, la adăugarea soluţiei de
amorsare a pompei, fiecare medicament trebuie adăugat în timpul recirculării amorsei pompei,
pentru a se asigura diluarea adecvată înainte de amestecarea cu cealaltă componentă. Perfuzia în
bolus iniţială este urmată de administrarea unei perfuzii continue de 250000-500000 UIK pe oră,
2
până la sfârşitul intervenţiei chirurgicale.
În general, cantitatea totală de aprotinină administrată într-o cură de tratament nu trebuie să
depăşească 7 milioane UIK.
Copii și adolescenți
Nu au fost stabilite siguranța și eficacitatea aprotininei la copii sub 18 ani.
Insuficiență renală
Experiențele clinice disponibile sugerează că pacienții cu insuficiență renală scăzută nu necesită
ajustarea dozei specială.
Insuficiență hepatică
Nu există date disponibile cu privire la recomandările de dozaj la pacienții cu insuficiență hepatică.
Vârstnici
Experiența clinică nu a menţionat nici o reacţie specifică la preparat la pacienții vârstnici.
Mod de administrare
Aprotinina pentru administrare intravenoasă trebuie administrată printr-un cateter venos central,
care nu se utilizează pentru administrarea altor preparate. Când se folosește un cateter central multilumen, atunci nu este necesară utilizarea unui cateter separat.
Aprotinina trebuie administrată numai pacienților în poziția culcat pe spate și se va administra lent
(viteza maximă - 5-10 ml pe minut) intravenos sau în perfuzie intravenoasă de scurtă durată.
4.3 Contraindicaţii
Hipersensibilitate la substanța activă sau la oricare dintre excipienții enumerați la pct. 6.1
La pacienţii cu anticorpi IgG, specifici la aprotinină, în tratamentul cu aprotinină se înregistrează un
risc crescut de anafilaxie. Tratamentul cu aprotinină pentru astfel de pacienţi este contraindicat.
Dacă efectuarea testului la anticorpi IgG specifici contra aprotininei înaintea iniţierii tratamentului
este imposibilă, dar se presupune, că pacientul a primit tratament cu aprotinină în ultimele 12 luni,
administrarea aprotininei este contraindicată.
4.4 Atenţionări şi precauţii speciale pentru utilizare
Aprotinina nu trebuie utilizată atunci când intervenţia de BAC este asociată cu o altă intervenţie
cardiovasculară, deoarece raportul risc-beneficiu pentru utilizarea aprotininei în cazul altor
proceduri cardiovasculare nu a fost stabilit.
Monitorizarea în laborator a anticoagulării în timpul bypass-ului cardiopulmonar
Aprotinina nu este un medicament care reduce consumul de heparină, fiind importantă menţinerea
anticoagulării adecvate cu heparină pe durata terapiei cu aprotinină. Sunt de aşteptat creşteri ale
valorilor timpului parţial de tromboplastină (APTT) şi ale timpului de coagulare activat de celite
(Celite ACT) la pacienţii trataţi cu aprotinină, în timpul intervenţiei chirurgicale şi în orele de după
aceasta. Prin urmare, în vederea menţinerii anticoagulării adecvate cu heparină nu trebuie
utilizat ca indicator timpul parţial de tromboplastină (APTT). La pacienţii cărora li se
efectuează bypass-ul cardiopulmonar în asociere cu tratament cu aprotinină, se recomandă
una dintre următoarele trei metode pentru monitorizarea anticoagulării adecvate: timpul de
coagulare activat (ACT), dozarea fixă de heparină sau titrarea heparinei (vezi mai jos). Dacă
se utilizează timpul de coagulare activat (ACT) pentru monitorizarea anticoagulării adecvate,
3
se recomandă o valoare a celite ACT de minim 750 secunde sau a caolin ACT de minim 480
secunde, în prezenţa aprotininei, indiferent de efectele hemodiluţiei şi hipotermiei.
Notă suplimentară privind circulaţia extracorporală
La pacienţii cărora li se efectuează bypass-ul cardiopulmonar în asociere cu tratament cu aprotinină,
se recomandă una dintre următoarele metode pentru monitorizare anticoagulării adecvate:
• Timpul de coagulare activat (ACT)
ACT nu este un test de coagulare standardizat, iar diferitele formule de testare sunt influenţate de
prezenţa aprotininei. Testul mai este influenţat de efectele diluţiei variabile şi de temperatura din
timpul bypass-ului cardiopulmonar. S-aobservat că aprotinina nu determină creşterea valorilor
rezultatelor la testele ACT pe bază de caolin în aceeaşi măsură comparativ cu testele ACT pe bază
de pământ diatomaceu (celite). Deşi protocoalele variază, în prezenţa aprotininei se recomandă o
valoare acelite ACT de minim 750 secunde sau acaolin ACTde minim 480 secunde, indiferent de
efectele hemodiluţiei şi hipotermiei. Consultaţi producătorul testului ACT cu privire la interpretarea
rezultatelor testării în prezenţa aprotininei.
• Dozare fixă de heparină
Doza standard de încărcare cu heparină, administrată înainte de cateterizarea cordului, plus
cantitatea de heparină adăugată la volumul amorsei din circuitul bypass-ului cardiopulmonar trebuie
să reprezinte în total cel puţin 350 UI/kg. Trebuie să se administreze o cantitate suplimentară de
heparină într-o schemă de dozaj cu doză fixă, în funcţie de greutatea pacientului şi durata
intervenţiei chirurgicale de bypass cardiopulmonar.
• Determinarea concentraţiilor de heparină
Dozarea protaminei, o metodă care nu este afectată de aprotinină, poate fi utilizată pentru măsurarea
concentraţiilor de heparină. Trebuie să se determine răspunsul la doza de heparină, evaluat prin
dozarea protaminei, înainte de administrarea aprotininei, pentru a determina doza de încărcare cu
heparină. Se administrează suplimentar heparină pe baza concentraţiilor de heparină măsurate prin
dozarea protaminei. Nu trebuie permisă scăderea concentraţiilor de heparină sub 2,7 U/ml (2,0
mg/kg) sau sub concentraţia indicată la testarea răspunsului la doza de heparină efectuată înainte de
administrarea aprotininei.
La pacienţii trataţi cu aprotinină, neutralizarea heparinei cu protamină după încheierea bypass-ului
cardiopulmonar fie trebuie să se bazeze pe un raport fix faţă de cantitatea de heparină administrată,
fie să fie controlată printr-o metodă de dozare a protaminei.
Important: aprotinina nu este un medicament care reduce consumul de heparină
Conservarea grefonului
Sângele recoltat prin cateterul central folosit pentru administrarea aprotininei nu trebuie utilizat
pentru conservarea grefonului.
Expunerea repetată la aprotinină
Administrarea de aprotinină, în special la pacienţii la care s-a administrat anterior aprotinină
(inclusiv aprotinină din produsele care conţin substanţe de legare a fibrinei) necesită o evaluare
risc/beneficiu atentă, deoarece poate apărea o reacţie alergică (vezi pct.4.3 şi 4.8). Deşi majoritatea
cazurilor de anafilaxie apar în cazul repetării expunerii în primele 12 luni, există şi raportări de
cazuri unice de anafilaxie care au apărut la repetarea expunerii după mai mult de 12 luni.
Tratament standard de urgenţă pentru reacţii alergice/anafilactice trebuie să fie disponibil în timpul
tratamentului cu aprotinină.
4
Evaluarea potenţialului de reacţii alergice
Tuturor pacienţilor trataţi cu aprotinină trebuie să li se administreze mai întâi o doză de test, pentru
a evalua posibilitatea unor reacţii alergice (vezi pct.4.2). Doza de test de aprotinină se administrează
numai când sunt disponibile la faţa locului facilităţi şi echipamente pentru gestionarea reacţiilor
anafilactice acute.
Insuficienţă renală
Rezultatele din studii observaţionale recente indică faptul că aprotinina poate determina disfuncţie
renală, în special la pacienţii cu disfuncţie renală preexistentă. O analiză globală a tuturor studiilor
placebo controlate la pacienţi cărora li s-a efectuat o intervenţie chirurgicală de bypass aortocoronarian (BAC) a indicat creşteri ale valorilor serice ale creatininei >0.5 mg/dl peste valoarea de
la momentul iniţial la pacienţii trataţi cu aprotinină (vezi pct.5.1). Prin urmare, se recomandă
evaluarea cu atenţie a profilului risc– beneficiu înainte de administrarea aprotininei la pacienţii cu
modificări ale funcţiei renale sau la cei cu factori de risc (cum este tratamentul concomitent cu
aminoglicozide).
La pacienţii cărora li s-a efectuat o intervenţie chirurgicală de bypass cardiopulmonar cu stop
circulator hipotermic profund în timpul intervenţiei la nivelul aortei toracice, trataţi cu aprotinină, sa raportat o creştere a incidenţei insuficienţei renale şi a mortalităţii comparativ cu grupul de control
cu vârste corespunzătoare, obţinut din date anterioare. Trebuie asigurată anticoagularea adecvată cu
heparină (vezi, de asemenea, mai sus).
Mortalitate
Informaţiile privind mortalitatea obţinute din studiile clinice randomizate sunt furnizate la pct.5.1.
S-a raportat o asociere între utilizarea aprotininei şi mortalitate crescută în unele studii
observaţionale nerandomizate (de ex. Mangano 2007, Schneeweiss 2008, Olenchock 2008, Shaw
2008) ,în timp ce alte studii nerandomizate nu au raportat o astfel de asociere (de ex. Karkouti
2006, Mangano 2006, Coleman 2007, Pagano 2008, Ngaage 2008, Karkouti 2009). În aceste studii,
aprotinina s-a administrat de obicei pacienţilor care prezent au mai mulţi factori de risc pentru
mortalitate crescută înaintea intervenţiei chirurgicale decât pacienţilor din alte grupuri de tratament.
Cele mai multe dintre studii nu au ţinut cont în mod adecvat de aceste diferenţe, cu privire la
factorii de risc, la momentul iniţial, iar influenţa acestor factori de risc asupra rezultatelor nu este
cunoscută. Prin urmare, interpretarea acestor studii observaţionale este limitată, iar asocierea dintre
utilizarea aprotininei şi mortalitatea crescută nu poate fi stabilită sau respinsă. De aceea, aprotinina
trebuie utilizată numai în situaţiile pentru care a fost autorizată, în cazuri izolate de intervenţie
chirurgicală BAC, după evaluarea cu atenţie a potenţialelor riscuri şi beneficii.
Un studiu publicat de Fergusson et al 2008 a analizat datele dintr-un studiu controlat randomizat,
”Blood Conservation Using Antifibrinolytic sin a Randomized Trial” (BART) şi a raportat o rată
mai ridicată a mortalităţii la pacienţii trataţi cu aprotinină comparativ cu cei trataţi cu acid
tranexamic sau acid aminocaproic. Totuşi, datorită mai multor deficienţe ale metodei, nu se poate
concluziona cu privire la riscurile cardiovasculare obţinute din studiul BART.
Excipienți
Gordox soluție injectabilă conține benzil-alcool. Benzil-alcoolul poate provoca reacții anafilactiode.
Gordox soluție injectabilă conține sodiu 1,45 mmol (33,42 mg) per doză. A se lua în considerație de
către pacienții care sunt la o dietă hiposodică.
4.5 Interacţiuni cu alte medicamente şi alte forme de interacţiune
Aprotinina are un efect inhibitor dependent de doză asupra acţiunii medicamentelor trombolitice, de
exemplu streptokinază, urokinază, alteplază (r-tPA).
5
Aprotinina poate declanşa insuficienţa renală, în special la pacienţii cu modificări preexistente ale
funcţiei renale. Aminoglicozidele reprezintă un factor de risc pentru apariţia insuficienţei renale.
4.6 Fertilitatea, sarcina şi alăptarea
Sarcina
Nu există studii adecvate şi bine controlate efectuate la femeile gravide.
Studiile la animale nu au furnizat dovezi privind efecte teratogene sau embriotoxice în cazul
aprotininei. Aprotinina trebuie utilizată în timpul sarcinii doar dacă raportul risc-beneficiu este
favorabil. În caz de reacţii adverse severe la medicament (cum sunt reacţia anafilactică, stopul
cardiac, etc.) şi al măsurilor terapeutice consecutive, la evaluarea raportului risc/beneficiu, trebuie
să se ia în vedere efectele adverse ale acestora asupra fetuşilor.
Alăptarea
Nu se cunoaşte dacă aprotinina se excretă în laptele uman. Totuşi, deoarece aprotinina nu este
biodisponibilă după administrarea orală, orice cantitate din medicament prezentă în lapte nu se
preconizează a avea un efect sistemic asupra copilului alăptat.
Fertilitatea
Nu există studii adecvate şi bine controlate asupra fertilităţii la bărbaţi sau femei.
4.7 Efecte asupra capacităţii de a conduce vehicule şi de a folosi utilaje
Nu sunt relevante.
4.8 Reacţii adverse
Rezumatul profilului de siguranță
Siguranţa aprotininei a fost evaluată în mai mult de patruzeci şi cinci de studii de fază II şi fază III,
care au inclus peste 3800 pacienţi cărora li s-a administrat aprotinină. În total, aproximativ 11%
dintre pacienţii trataţi cu aprotinină au prezentat reacţii adverse. Cea mai gravă reacţie adversă a
fost infarctul miocardic. Reacţiile adverse trebuie interpretate în contextul intervenţiilor
chirurgicale.
Reacţiile alergice/anafilactice sunt rare la pacienţii cărora nu li s-a administrat anterior aprotinină.
În cazul expunerii repetate, incidenţa reacţiilor alergice/anafilactice poate atinge frecvenţa de 5%. O
analiză retrospectivă a indicat că incidenţa unei reacţii alergice/anafilactice în urma expunerii
repetate este crescută în cazul în care expunerea repetată survine în interval de 6 luni de la
administrarea iniţială(5% pentru expunerea repetată în interval de 6 luni şi 0,9 % pentru expunerea
repetată la mai mult de 6 luni). O analiză retrospectivă sugerează că incidenţa reacţiilor anafilactice
severe la aprotinină poate creşte şi mai mult când pacienţii sunt expuşi repetat de mai mult de două
ori în interval de 6 luni. Chiar şi în cazul în care o a doua expunere la aprotinină a fost tolerată fără
7
simptome, o administrare ulterioară poate conduce la reacţii alergice severe sau la şoc anafilactic,
cu rezultat fatal, în cazuri foarte rare.
Simptomele reacţiilor alergice/anafilactice pot include:
Sistemul respirator: astm (bronhospasm)
Sistemul cardiovascular: hipotensiune arterială
Piele şi anexe cutanate: prurit, erupţie cutanată tranzitorie, urticarie
Sistemul digestiv: greaţă
Dacă apar reacţii alergice în timpul injecţiei sau perfuziei, administrarea trebuie oprită imediat.
Poate fi necesar tratament standard de urgenţă, respectiv administrarea de adrenalină/epinefrină,
reechilibrare volemică şi administrarea de corticosteroizi.
Sistemul cardiovascular
În cadrul analizei globale a tuturor studiilor clinice placebo controlate, incidenţa infarctului
miocardic (IM) raportat de investigator la pacienţii trataţi cu aprotinină a fost de 5,8% comparativ
cu 4,8% la pacienţii la care s-a administrat placebo, diferenţa dintre grupuri fiind de 0,98%
(aprotinina n=3817 şi placebo n=2682;status: Aprilie 2005).
În unele studii a fost observată o tendinţă de incidenţă crescută a IM în asociere cu aprotinina, în
timp ce alte studii au evidenţiat o incidenţă mai scăzută comparativ cu placebo.
Mortalitate
Pentru informaţiile cu privire la riscul de mortalitate asociat cu utilizarea aprotininei, vezi pct.4.4.
Raportarea reacțiilor adverse suspectate
Raportarea reacțiilor adverse suspectate după autorizarea medicamentului este importantă. Aceasta
permite monitorizarea în continuare a raportului beneficiu/risc al medicamentului. Profesioniștii din
domeniul sănătății sunt rugați să raporteze orice reacții adverse suspectate, prin intermediul
sistemului național de raportare disponibil pe site-ul oficial al Agenţiei Medicamentului şi
Dispozitivelor Medicale la următoarea adresă web: www.amed.md sau e-mail:
[email protected]
4.9 Supradozaj
Nu există un antidot specific.
5. PROPRIETĂŢI FARMACOLOGICE
5.1 Proprietăţi farmacodinamice
Grupa farmacoterapeutică: Antihemoragice, inhibitori de proteinază, codul ATC: B02AB01
Aprotinina este un inhibitor de protează cu spectru larg, cu proprietăţi antifibrinolitice. Prin
formarea de complexe inhibitoare enzimatice, stoechiometric reversibile, aprotinina acţionează ca
inhibitor pentru tripsina, plasmina, kalikreina plasmatică şi kalikreina tisulară umane, inhibând
astfel fibrinoliza. Aceasta inhibă, de asemenea, activarea coagulării în faza de contact, care iniţiază
coagularea şi promovează fibrinoliza.
Datele provenind dintr-o analiză globală a studiilor placebo controlate la pacienţi cărora li s-a
efectuat o intervenţie chirurgicală de bypass aorto-coronarian (BAC) au indicat că incidenţa
creşterilor valorilor serice ale creatininei >0.5mg/dl peste valorile premergătoare tratamentului a
fost mai crescută din punct de vedere statistic, la valoarea de 9,0% (185/2047) la grupul la care s-a
administrat doza completă de aprotinină, comparativ cu 6,6% (129/1957) la grupul la care s-a
8
administrat placebo, cu un risc relativ de 1,41 (1,12-1,79). În majoritatea cazurilor, disfuncţia renală
post-operatorie nu a fost severă, fiind reversibilă. Incidenţa creşterii valorilor serice ale creatininei
>2.0mg/dl peste valoarea de la momentul iniţial a fost similară (1,1% față de0,8%) atât la grupul la
care s-a administrat doza completă de aprotinină, cât şi la grupul la care s-a administrat placebo, cu
un risc relativ de 1,16 (0,73-1,85) (vezi pct.4.4)
5.2 Proprietăţi farmacocinetice
Absorbție, distribuție
După injecţia intravenoasă, are loc distribuţia rapidă a aprotininei în spaţiul extracelular, ceea ce
duce la o scădere iniţială a concentraţiei plasmatice de aprotinină, cu un timp de înjumătăţire de
0,3-0,7 ore. La momente ulterioare administrării (adică după 5 ore de la administrarea dozei) timpul
de înjumătăţire plasmatică prin eliminare este de aproximativ 5-10 ore.
Se pare că bariera feto-placentară nu este complet impermeabilă pentru aprotinină, însă traversarea
acestei bariere pare să se facă lent.
Metabolizare, eliminare
Molecula de aprotinină este metabolizată în peptide mai scurte sau aminoacizi, prin activitatea
lizozomală din rinichi. La bărbaţi, excreţia urinară de aprotinină activă reprezintă mai puţin de 5%
din doză. După administrarea injecţiilor cu 131I-aprotinină, la voluntari sănătoşi, 25-40% din
substanţa marcată s-a excretat sub formă de metaboliţi în urină în intervalul de 48 ore de la
administrare. Aceşti metaboliţi nu mai prezentau activitate inhibatoare enzimatică.
Nu sunt disponibile studii de farmacocinetică la pacienţi cu insuficienţă renală stadiul terminal.
Studiile la pacienţi cu insuficienţă renală nu au evidenţiat modificări ale farmacocineticii
semnificative din punct de vedere clinic sau reacţii adverse evidente. Nu se recomandă o ajustare a
dozei.
5.3 Date preclinice de siguranţă
Toxicitatea acută
La şobolani, porcuşori de guineea, iepuri şi câini, administrarea de doze mari (>150.000UIK/kg)
prin injectare rapidă a determinat o scădere a tensiunii arteriale de diferite magnitudini, care s-a
ameliorat rapid.
Toxicitatea asupra funcţiei de reproducere
În studiile la şobolani, dozele zilnice de până la 80000UIK/kg administrate intravenos nu au
determinat toxicitate maternă, embriotoxicitate sau fetotoxicitate. Administrarea de doze zilnice de
până la 100000 UIK/kg nu a afectat creşterea şi dezvoltarea puilor,iar dozele de 200000 UIK/kg şi
9
zi nu au avut efect teratogen. La iepuri, dozele zilnice de 100000UIK/kg administrate intravenos nu
au evidenţiat toxicitate maternă, embriotoxicitate, fetotoxicitate sau teratogenitate.
Potenţialul mutagen
Aprotinina a prezentat un răspuns mutagen negativ la testarea sistemului de deteriorare a ADN cu
Salmonella/microzom şi B.subtilis.
6. PROPRIETĂŢI FARMACEUTICE
6.1 Lista excipienţilor
clorură de sodiu,
alcool benzilic,
hidroxid de sodiu,
acid clorhidric,
apă distilată pentru preparate injectabile.
6.2 Incompatibilităţi
Aprotinina practic este incompatibilă cu alte preparate. Nu se administrează în perfuzii mixte. La
necesitate, se poate dizolva în soluţie de clorură de sodiu 0,9% sau cel puţin în 500 ml de soluţie de
glucoză 5%. Preparatul, dizolvat în glucoză, trebuie administrat în decurs de 4 ore.
Din cauza incompatibilităţii chimice, nu se administrează concomitent cu corticosteroizi, soluţii
pentru alimentaţie parenterală, care conţin aminoacizi şi grăsimi.
6.3 Perioada de valabilitate
60 luni
6.4 Precauţii speciale pentru păstrare
A se păstra la temperaturi sub 30°C. A se păstra în ambalajul original, pentru a fi protejat de lumină.
Dacă conținutul fiolei este tulbure, ea nu trebuie administrată. Fiolele deschise trebuie utilizate
imediat.
6.5 Natura şi conţinutul ambalajului
10 ml soluție în fiole transparente, OPC- cu punct de rupere.
25 fiole OPC cu punct de rupere, pe tavă de plastic, în cutie de carton împreună cu instrucțiunea
pentru utilizator.
6.6 Precauţii speciale pentru eliminarea reziduurilor şi alte instrucţiuni de manipulare
Medicamentele administrate parenteral trebuie inspectate vizual pentru evidențierea de particule și
schimbarea culorii înainte de administrare. Orice soluție reziduală nu trebuie să fie păstrată pentru o
ulterioară utilizare.
Orice produs neutilizat sau material rezidual trebuie eliminat în conformitate cu reglementările
locale.
Medicamentul face obiectul prescripției medicale limitate pentru utilizare în condițiile stabilite de
furnizorii de asistență medicală care oferă asistență medicală specializată în ambulatoriu sau spital.
0
Nu este disponibil
Indicaţii terapeutice
Hemoroizi, fisuri anale.
Doze şi mod de administrare
Rectal.
Se administrează rectal profund după clismă evacuatoare sau după defecare spontană.
Adulţilor şi copiilor cu vârsta peste 12 ani – câte 1 supozitor de 1-2 ori pe zi.
Durata tratamentului – 7-10 zile.
Nu se recomandă timp de tratament mai îndelungat. Contraindicaţii
Hipersensibilitate la substanțele active sau la oricare dintre excipienți enumărați la pct. 6.1; copii
cu vârsta până la 12 ani. https://bit.ly/3y541sn
Hemoroizi, fisuri anale.
Doze şi mod de administrare
Rectal.
Se administrează rectal profund după clismă evacuatoare sau după defecare spontană.
Adulţilor şi copiilor cu vârsta peste 12 ani – câte 1 supozitor de 1-2 ori pe zi.
Durata tratamentului – 7-10 zile.
Nu se recomandă timp de tratament mai îndelungat. Contraindicaţii
Hipersensibilitate la substanțele active sau la oricare dintre excipienți enumărați la pct. 6.1; copii
cu vârsta până la 12 ani. https://bit.ly/3y541sn
0
Nu este disponibil
INDICAȚII
- Extern și hemoroizi interni;
- Eroziunea și fisuri;
- Mâncărime Anal;
- Scopul ameliorarea durerii după operații proctologice;
- În timpul procedurilor de diagnosticare.
DOZARE
Ar trebui să fie utilizat după procedurile de igienă.
Supozitoarele sunt administrate în rect dimineata, peste noapte și după fiecare scaun.
Adulti si copii peste 12 ani
Se recomanda administrat 1 suppozitoriu in timp / zi.
Pentru a aplica unguentul ar trebui să fie eliminate din capacul aplicator, atașați aplicatorul la tub și stoarce o cantitate mică de unguent pentru a lubrifia aplicator.
Unguent introdus cu atenție de către un aplicator pentru 4 ori timp / zi (dimineață, după-amiaza și seara și după fiecare scaun).
După fiecare utilizare, aplicatorul trebuie să fie bine spălat și plasat într-un capac de protecție.
Copiii sub 12 an medicamentul este prescris sub supraveghere medicală.
EFECT SECUNDAR
Reacții locale: Hiperemia, mâncărime.
Sunt reacții alergice.
CONTRAINDICAȚII
- Tromboembolism;
- Granulozitopenia;
- Hipersensibilitate la medicament.
Sarcina și alăptarea
Consumul de Relief Advance in timpul sarcinii și alăptării (alăptarea) cu prudență și numai, dacă beneficiul așteptat pentru mamă depășește riscul potențial pentru făt sau copil.
- Extern și hemoroizi interni;
- Eroziunea și fisuri;
- Mâncărime Anal;
- Scopul ameliorarea durerii după operații proctologice;
- În timpul procedurilor de diagnosticare.
DOZARE
Ar trebui să fie utilizat după procedurile de igienă.
Supozitoarele sunt administrate în rect dimineata, peste noapte și după fiecare scaun.
Adulti si copii peste 12 ani
Se recomanda administrat 1 suppozitoriu in timp / zi.
Pentru a aplica unguentul ar trebui să fie eliminate din capacul aplicator, atașați aplicatorul la tub și stoarce o cantitate mică de unguent pentru a lubrifia aplicator.
Unguent introdus cu atenție de către un aplicator pentru 4 ori timp / zi (dimineață, după-amiaza și seara și după fiecare scaun).
După fiecare utilizare, aplicatorul trebuie să fie bine spălat și plasat într-un capac de protecție.
Copiii sub 12 an medicamentul este prescris sub supraveghere medicală.
EFECT SECUNDAR
Reacții locale: Hiperemia, mâncărime.
Sunt reacții alergice.
CONTRAINDICAȚII
- Tromboembolism;
- Granulozitopenia;
- Hipersensibilitate la medicament.
Sarcina și alăptarea
Consumul de Relief Advance in timpul sarcinii și alăptării (alăptarea) cu prudență și numai, dacă beneficiul așteptat pentru mamă depășește riscul potențial pentru făt sau copil.
0
Nu este disponibil
INDICAŢII TERAPEUTICE
Terapia simptomatică a pruritului perianal, senzației de arsură și disconfort, care însoțesc hemoroizii externi și interni, fisurile anale, eroziile și microtraumatismele zonei ano-rectale.
DOZE ŞI MOD DE ADMINISTRARE
Se administrează rectal, după efectuarea toaletei locale.
Cîte 1 supozitor dimineaţa, pe noapte și după fiecare defecaţie, maxim de 4 ori pe zi.
CONTRAINDICAŢII
- Hipersensibilitate la componentele medicamentului;
- trombembolia;
- granulocitopenia;
- copii cu vîrsta până la 12 ani.
SUPRADOZAJ
Excesul substanțial al dozelor unice și zilnice recomandate de ulei din ficat de rechin poate duce la accelerarea coagulării sîngelui. La apariția simptoamelor de supradozaj este necesară adresarea la medic.
Terapia simptomatică a pruritului perianal, senzației de arsură și disconfort, care însoțesc hemoroizii externi și interni, fisurile anale, eroziile și microtraumatismele zonei ano-rectale.
DOZE ŞI MOD DE ADMINISTRARE
Se administrează rectal, după efectuarea toaletei locale.
Cîte 1 supozitor dimineaţa, pe noapte și după fiecare defecaţie, maxim de 4 ori pe zi.
CONTRAINDICAŢII
- Hipersensibilitate la componentele medicamentului;
- trombembolia;
- granulocitopenia;
- copii cu vîrsta până la 12 ani.
SUPRADOZAJ
Excesul substanțial al dozelor unice și zilnice recomandate de ulei din ficat de rechin poate duce la accelerarea coagulării sîngelui. La apariția simptoamelor de supradozaj este necesară adresarea la medic.
0
Nu este disponibil
0
Nu este disponibil
Indicaţii terapeutice:
Hemoroizi, fisuri anale, ulcere rectale, proctite, proctosigmoidite nespecifice, după
intervenţii reconstructive pe intestinul gros, afecţiuni actinice ale mucoasei
segmentului inferior a intestinului gros.
Doze şi mod de administrare:
Se administrează rectal, adulţilor cîte un supozitor de 1-2 ori/zi, dimineaţa şi seara.
Durata medie a curei de tratament constituie 10-15 zile.
Contraindicaţii:
Hipersensibilitate la componentele medicamentului. https://bit.ly/3hiY2du
Hemoroizi, fisuri anale, ulcere rectale, proctite, proctosigmoidite nespecifice, după
intervenţii reconstructive pe intestinul gros, afecţiuni actinice ale mucoasei
segmentului inferior a intestinului gros.
Doze şi mod de administrare:
Se administrează rectal, adulţilor cîte un supozitor de 1-2 ori/zi, dimineaţa şi seara.
Durata medie a curei de tratament constituie 10-15 zile.
Contraindicaţii:
Hipersensibilitate la componentele medicamentului. https://bit.ly/3hiY2du
0
Nu este disponibil
VICASOL-DARNIŢA
soluţie injectabilă
DENUMIREA COMERCIALĂ
Vicasol-Darniţa
DCI-ul substanţei active
Menadione sodium bisulfite
COMPOZIŢIA
1 ml soluţie conţine:
substanţa activă: vicasol (menadionă bisulfit de sodiu) - 10 mg; excipienţi: metabisulfit de sodiu, soluţie de acid clorhidric, apă pentru injecţii.
FORMA FARMACEUTICĂ
Soluţie injectabilă.
DESCRIEREA MEDICAMENTULUI
Lichid transparent, incolor sau cu nuanţă slab gălbuie.
GRUPA FARMACOTERAPEUTICĂ şi codul ATC
Vitamina K şi alte hemostatice, B02B A02.
PROPRIETĂŢILE FARMACOLOGICE
Proprietăţi farmacodinamice
Există mai multe forme ale vitaminei K. Principala formă de vitamina K - vitamina K1 (filochinona) se găseşte în plante, în special legume cu frunze verzi. O altă formă de vitamina K este vitamina K2 (menachinona), care poate fi absorbită într-o cantitate limitată. Această formă de vitamina K este sintetizată de microflora intestinală în porţiunea distală a intestinului subţire şi colon.
Vicasol-Darnitsa este un analog sintetic al vitaminei K şi este cunoscut sub denumirea de Vitamina K3 (menadiona), contribuie la sinteza protrombinei şi proconvertinei, creşte coagulabilitatea sîngelui prin accelerarea sintezei factorilor de coagulare II, VII, IX, X. Manifestă acţiune hemostatică (deficitul de vitamina K provoacă sîngerare). &În sînge protrombina (factorul II) în prezenţa tromboplastinei şi Ca2+, cu participarea proconvertinei (factorul VII), factorului IX (Christmas), factorului X (Stuart-Prower ) se transformă în trombină, sub influenţa căreia fibrinogenul se transformă în fibrină, componenta de bază a trombului.
Vicasol-Darnitsa ca substrat stimulează reductaza vitaminei-K, care activează vitamina K, necesară sintezei dependente de vitamina-K a factorilor plasmatici de coagulare în ficat.
Rolul vitaminei K în organismul uman şi animal nu se reduce doar la biosinteza factorilor procoagulanţi. Vitamina K manifestă acţiune asupra unui şir de procese anabolice. Este importantă pentru metabolismul compuşilor macroergici, pentru formarea ATP-ului. Insuficienţa de vitamina K duce la deficitul de ATP şi diminuarea sintezei multor compuşi, nu numai a procoagulantelor, dar şi a multor proteine,
inclusiv un şir de enzime, care nu au legătură directă cu procesul de coagulare. &În caz de deficit de vitamina K de asemenea este diminuată sinteza unor substanţe biologic active de origine neproteică precum: serotonina, histamina, acetilcolina. Debutul acţiunii - peste 8-24 ore după administrarea intramusculară.
Proprietăţile farmacocinetice
După administrarea intramusculară se absoarbe uşor şi rapid în sistemul sanguin. Legarea de proteinele plasmatice este reversibilă. &În cazul pacienţilor cu hipoalbuminemie legarea de proteinele plasmatice este foarte joasă sau nu are loc în general. Se cumulează preponderent în ficat, splină, miocard. Cel mai intens proces de metabolizare are loc în miocard, muşchi scheletici, mai slab - rinichi. Se elimină pe cale renală şi cu bila exclusiv sub formă de metaboliţi. Metaboliţii vitaminei K (monosulfat, fosfat şi diglucuronid-2-metil-1,4-naftochinonă) se elimină prin rinichi - până la 70 %. Concentraţii crescute de vitamina K în masele fecale sunt determinate de sinteza vitaminei K de microflora intestinală.
INDICAŢII TERAPEUTICE
Vicasol se indică în caz de hemoragii şi pe fondal de hipoprotrombinemie cauzată de hepatita acută, în hemoragii parenchimatoase şi capilariene.
După intervenţii chirurgicale şi traumatisme, ulcer gastric sau duodenal hemoragic, boala de iradiere acută manifestă, hemoragii nazale şi hemoroidale prelungite. Preparatul se indică şi în boala hemoragică a prematurilor, hemoragii uterine premenopauzale şi juvenile, hemoragii spontane, preoperator dacă există risc de hemoragie postoperatorie; hemoragie pulmonară; manifestări hemoragice în afceţiunile septice.
La fel, Vicasol-Darnitsa se indică în hemoragia şi hipotrombinemia determinată de supradozarea cu fenilină, neodicumarină, alte anticoagulante - antagonişti ai vitaminei K.
DOZE ŞI MOD DE ADMINISTRARE
Preparatul se administrează intramuscular.
Adulţi - doza la o administrare - 10 mg, doza maximă la o administrare - 15 mg, doza nictemerală maximă - 30 mg.
Durata tratamentului - 3-4 zile, după o pauză de 4 zile, la necesitate tratamentul poate fi repetat.
&În caz de intervenţii chirurgicale cu posibile hemoragii parenchimatoase severe preparatul se va administra cu 2-3 zile înainte de intervenţie.
Copii: cu vîrsta sub 1 an - 2-5 mg/zi; 1-2 ani - 6 mg/zi; 3-4 ani - 8 mg/zi; 5-9 ani - 10 mg/zi; 10-18 ani - 15 mg/zi. Doza se va administra în două prize. Durata tratamentului va fi stabilită de medicul curant.
REACŢII ADVERSE
Reacţii alergice: hiperemie facială, erupţii cutante (inclusiv eritematoase, urticarie), prurit cutant, bronhospasm.
Tulburări hematologice şi limfatice: anemie hemolitică, hemoliză la nou-născuţii cu deficit congenital de glucozo-6-fosfatdehidrogenază sau la pacienţii cu deficit de vitamina E, trombembolie.
Tulburări cardio-vasculare: hipotensiune arterială tranzitorie, tahicardie, umplere slabă a pulsului.
Tulburări generale şi la nivelul locului de administrare: durere şi tumefiere la locul de aadministrare, modificarea culorii pielii în cazul administrării preparatului în unul şi acelaşi loc. Vicasol poate provoca sclerodermie locală.
Alte: hiperbilirubinemie, icter (inclusiv icter nuclear la nou-născuţi), vertij, transpiraţii profuze, disgeuzie, bufeuri de căldură.
CONTRAINDICAŢII
Hipersensibilitate la substanţa activă sau orice component al preparatului. Hipercoagulare, trombembolie.
Boala hemolitică a nou-născutului.
Insuficienţă hepatică severă.
Deficit de glucozo-6-fosfatdehidrogenază.
SUPRADOZAJ
Simptome: hipervitaminoză K care se manifestă prin hiperprotrombinemie şi hipertrombinemie, hiperbilirubinemie, icter, creşterera activi tăţii transaminazelor hepatice; durere abdominală, constipaţie sau diaree, excitabilitate, agitaţie şi erupţii cutanate. &În cazuri unice la copii pot apărea semne de toxicoză manifestate prin convulsii.
Tratament: sistarea preparatului. Se vor administra anticoagulante sub controlul indicilor de coagulare. Tratament simptomatic.
ATENŢIONĂRI ŞI PRECAUŢII SPECIALE DE UTILIZARE
Se va ţine cont că în timpul administrării Vicasol-Darnitsa poate avea loc inhibarea agregării plachetare. &În hemofilie, purpura trombocitropenică şi boala Verlgof preparatul este ineficient.
Pentru profilaxia bolii hemoragice la nou-născut administrarea de fitomenadionă este mai benefică, deoarece mai rar provoacă la nou-născut (inclusiv prematuri) hiperbilirubinemie şi anemie hemolitică.
Administrarea în sarcină şi perioada de alăptare Vicasol-Darnitsa face parte din grupul de preparate cu risc pentru gravide. Administrarea preparatului în trimestrele unu şi doi de sarcină este posibilă doar după evaluarea atentă a raportului beneficiu pentru mamă/risc potenţial pentru făt.
Indicarea profilactică a vitaminei K în trimestrul trei de sarcină este ineficientă din cauza penetrabilităţii joase a placentei.
La necesitatea administrării preparatului în timpul alăptării, se recomandă de a întrerupe alăptarea pe parcursul tratamentului.
Administrarea ia copii
Vicasol-Darnitsa se administrează în practica pediatrică.
Influenţa asupra capacităţii de a conduce vehicule sau de a folosi utilaje
Vicasol-Darnitsa nu influenţează capacitatea de a conduce vehicule sau de a folosi utilaje. Dacă în timpul administrării apar vertijuri, pacientul trebuie să se abţină de a conduce vehicule sau să folosească utilaje.
INTERACŢIUNI CU ALTE MEDICAMENTE, ALTE TIPURI DE INTERACŢIUNI
La administrarea concomitentă cu anticoagulante orale este posibilă reducerea acţiunii anticoagulante. Reduce efectul anticoagulantelor indirecte (inclusiv derivaţii de cumarină şi indanadionă). Nu influenţează asupra acţiunii anticoagulante a heparinei. Administrarea concomitentă cu antibiotice cu spectru larg de acţiune, chinidină, chinină, salicilaţi în doze mari, sulfonamide este necesară creşterea dozei de vitamina K.
Creşte riscul de reacţii adverse la administrarea concomitentă cu preparate hemolitice. La administrarea concomitentă cu agregante şi inhibitori ai fibrinolizei are loc potenţarea efectului hemostatic.
Incompatibilităţi
Vicasol-Darnitsa este incompatibil cu sulfanilamide, PASC, salicilaţi, oxicumarină. Este incompatibil în aceeaşi seringă cu soluţii alcaline sau acide.
Substanţa activă a preparatului se inactivează la acţiunea directă a razelor solare.
PREZENTARE, AMBALAJ
Soluţie injectabilă 10 mg/ml.
Câte 5 fiole în blister. Câte 2 blistere împreună cu instrucţiunea pentru administrare în cutie de carton.
PĂSTRARE
A se păstra la temperatura 2-8 °C, în ambalajul original.
A nu se lăsa la îndemâna şi vederea copiilor!
TERMEN DE VALABILITATE
2 ani.
A nu se utiliza după data de expirare indicată pe ambalaj.
STATUTUL LEGAL
Cu prescripţie medicală.
DATA ULTIMEI REVIZUIRI A TEXTULUI
Iulie 2014.
DEŢINĂTORUL CERTIFICATULUI DE &ÎNREGISTRARE
SAP "Firma farmaceutică "Darniţa", Ucraina
NUMELE ŞI ADRESA PRODUCĂTORULUI
SAP "Firma farmaceutică "Darniţa",
Ucraina, 02093, or. Kiev, str. Borispolskaya, 13.
soluţie injectabilă
DENUMIREA COMERCIALĂ
Vicasol-Darniţa
DCI-ul substanţei active
Menadione sodium bisulfite
COMPOZIŢIA
1 ml soluţie conţine:
substanţa activă: vicasol (menadionă bisulfit de sodiu) - 10 mg; excipienţi: metabisulfit de sodiu, soluţie de acid clorhidric, apă pentru injecţii.
FORMA FARMACEUTICĂ
Soluţie injectabilă.
DESCRIEREA MEDICAMENTULUI
Lichid transparent, incolor sau cu nuanţă slab gălbuie.
GRUPA FARMACOTERAPEUTICĂ şi codul ATC
Vitamina K şi alte hemostatice, B02B A02.
PROPRIETĂŢILE FARMACOLOGICE
Proprietăţi farmacodinamice
Există mai multe forme ale vitaminei K. Principala formă de vitamina K - vitamina K1 (filochinona) se găseşte în plante, în special legume cu frunze verzi. O altă formă de vitamina K este vitamina K2 (menachinona), care poate fi absorbită într-o cantitate limitată. Această formă de vitamina K este sintetizată de microflora intestinală în porţiunea distală a intestinului subţire şi colon.
Vicasol-Darnitsa este un analog sintetic al vitaminei K şi este cunoscut sub denumirea de Vitamina K3 (menadiona), contribuie la sinteza protrombinei şi proconvertinei, creşte coagulabilitatea sîngelui prin accelerarea sintezei factorilor de coagulare II, VII, IX, X. Manifestă acţiune hemostatică (deficitul de vitamina K provoacă sîngerare). &În sînge protrombina (factorul II) în prezenţa tromboplastinei şi Ca2+, cu participarea proconvertinei (factorul VII), factorului IX (Christmas), factorului X (Stuart-Prower ) se transformă în trombină, sub influenţa căreia fibrinogenul se transformă în fibrină, componenta de bază a trombului.
Vicasol-Darnitsa ca substrat stimulează reductaza vitaminei-K, care activează vitamina K, necesară sintezei dependente de vitamina-K a factorilor plasmatici de coagulare în ficat.
Rolul vitaminei K în organismul uman şi animal nu se reduce doar la biosinteza factorilor procoagulanţi. Vitamina K manifestă acţiune asupra unui şir de procese anabolice. Este importantă pentru metabolismul compuşilor macroergici, pentru formarea ATP-ului. Insuficienţa de vitamina K duce la deficitul de ATP şi diminuarea sintezei multor compuşi, nu numai a procoagulantelor, dar şi a multor proteine,
inclusiv un şir de enzime, care nu au legătură directă cu procesul de coagulare. &În caz de deficit de vitamina K de asemenea este diminuată sinteza unor substanţe biologic active de origine neproteică precum: serotonina, histamina, acetilcolina. Debutul acţiunii - peste 8-24 ore după administrarea intramusculară.
Proprietăţile farmacocinetice
După administrarea intramusculară se absoarbe uşor şi rapid în sistemul sanguin. Legarea de proteinele plasmatice este reversibilă. &În cazul pacienţilor cu hipoalbuminemie legarea de proteinele plasmatice este foarte joasă sau nu are loc în general. Se cumulează preponderent în ficat, splină, miocard. Cel mai intens proces de metabolizare are loc în miocard, muşchi scheletici, mai slab - rinichi. Se elimină pe cale renală şi cu bila exclusiv sub formă de metaboliţi. Metaboliţii vitaminei K (monosulfat, fosfat şi diglucuronid-2-metil-1,4-naftochinonă) se elimină prin rinichi - până la 70 %. Concentraţii crescute de vitamina K în masele fecale sunt determinate de sinteza vitaminei K de microflora intestinală.
INDICAŢII TERAPEUTICE
Vicasol se indică în caz de hemoragii şi pe fondal de hipoprotrombinemie cauzată de hepatita acută, în hemoragii parenchimatoase şi capilariene.
După intervenţii chirurgicale şi traumatisme, ulcer gastric sau duodenal hemoragic, boala de iradiere acută manifestă, hemoragii nazale şi hemoroidale prelungite. Preparatul se indică şi în boala hemoragică a prematurilor, hemoragii uterine premenopauzale şi juvenile, hemoragii spontane, preoperator dacă există risc de hemoragie postoperatorie; hemoragie pulmonară; manifestări hemoragice în afceţiunile septice.
La fel, Vicasol-Darnitsa se indică în hemoragia şi hipotrombinemia determinată de supradozarea cu fenilină, neodicumarină, alte anticoagulante - antagonişti ai vitaminei K.
DOZE ŞI MOD DE ADMINISTRARE
Preparatul se administrează intramuscular.
Adulţi - doza la o administrare - 10 mg, doza maximă la o administrare - 15 mg, doza nictemerală maximă - 30 mg.
Durata tratamentului - 3-4 zile, după o pauză de 4 zile, la necesitate tratamentul poate fi repetat.
&În caz de intervenţii chirurgicale cu posibile hemoragii parenchimatoase severe preparatul se va administra cu 2-3 zile înainte de intervenţie.
Copii: cu vîrsta sub 1 an - 2-5 mg/zi; 1-2 ani - 6 mg/zi; 3-4 ani - 8 mg/zi; 5-9 ani - 10 mg/zi; 10-18 ani - 15 mg/zi. Doza se va administra în două prize. Durata tratamentului va fi stabilită de medicul curant.
REACŢII ADVERSE
Reacţii alergice: hiperemie facială, erupţii cutante (inclusiv eritematoase, urticarie), prurit cutant, bronhospasm.
Tulburări hematologice şi limfatice: anemie hemolitică, hemoliză la nou-născuţii cu deficit congenital de glucozo-6-fosfatdehidrogenază sau la pacienţii cu deficit de vitamina E, trombembolie.
Tulburări cardio-vasculare: hipotensiune arterială tranzitorie, tahicardie, umplere slabă a pulsului.
Tulburări generale şi la nivelul locului de administrare: durere şi tumefiere la locul de aadministrare, modificarea culorii pielii în cazul administrării preparatului în unul şi acelaşi loc. Vicasol poate provoca sclerodermie locală.
Alte: hiperbilirubinemie, icter (inclusiv icter nuclear la nou-născuţi), vertij, transpiraţii profuze, disgeuzie, bufeuri de căldură.
CONTRAINDICAŢII
Hipersensibilitate la substanţa activă sau orice component al preparatului. Hipercoagulare, trombembolie.
Boala hemolitică a nou-născutului.
Insuficienţă hepatică severă.
Deficit de glucozo-6-fosfatdehidrogenază.
SUPRADOZAJ
Simptome: hipervitaminoză K care se manifestă prin hiperprotrombinemie şi hipertrombinemie, hiperbilirubinemie, icter, creşterera activi tăţii transaminazelor hepatice; durere abdominală, constipaţie sau diaree, excitabilitate, agitaţie şi erupţii cutanate. &În cazuri unice la copii pot apărea semne de toxicoză manifestate prin convulsii.
Tratament: sistarea preparatului. Se vor administra anticoagulante sub controlul indicilor de coagulare. Tratament simptomatic.
ATENŢIONĂRI ŞI PRECAUŢII SPECIALE DE UTILIZARE
Se va ţine cont că în timpul administrării Vicasol-Darnitsa poate avea loc inhibarea agregării plachetare. &În hemofilie, purpura trombocitropenică şi boala Verlgof preparatul este ineficient.
Pentru profilaxia bolii hemoragice la nou-născut administrarea de fitomenadionă este mai benefică, deoarece mai rar provoacă la nou-născut (inclusiv prematuri) hiperbilirubinemie şi anemie hemolitică.
Administrarea în sarcină şi perioada de alăptare Vicasol-Darnitsa face parte din grupul de preparate cu risc pentru gravide. Administrarea preparatului în trimestrele unu şi doi de sarcină este posibilă doar după evaluarea atentă a raportului beneficiu pentru mamă/risc potenţial pentru făt.
Indicarea profilactică a vitaminei K în trimestrul trei de sarcină este ineficientă din cauza penetrabilităţii joase a placentei.
La necesitatea administrării preparatului în timpul alăptării, se recomandă de a întrerupe alăptarea pe parcursul tratamentului.
Administrarea ia copii
Vicasol-Darnitsa se administrează în practica pediatrică.
Influenţa asupra capacităţii de a conduce vehicule sau de a folosi utilaje
Vicasol-Darnitsa nu influenţează capacitatea de a conduce vehicule sau de a folosi utilaje. Dacă în timpul administrării apar vertijuri, pacientul trebuie să se abţină de a conduce vehicule sau să folosească utilaje.
INTERACŢIUNI CU ALTE MEDICAMENTE, ALTE TIPURI DE INTERACŢIUNI
La administrarea concomitentă cu anticoagulante orale este posibilă reducerea acţiunii anticoagulante. Reduce efectul anticoagulantelor indirecte (inclusiv derivaţii de cumarină şi indanadionă). Nu influenţează asupra acţiunii anticoagulante a heparinei. Administrarea concomitentă cu antibiotice cu spectru larg de acţiune, chinidină, chinină, salicilaţi în doze mari, sulfonamide este necesară creşterea dozei de vitamina K.
Creşte riscul de reacţii adverse la administrarea concomitentă cu preparate hemolitice. La administrarea concomitentă cu agregante şi inhibitori ai fibrinolizei are loc potenţarea efectului hemostatic.
Incompatibilităţi
Vicasol-Darnitsa este incompatibil cu sulfanilamide, PASC, salicilaţi, oxicumarină. Este incompatibil în aceeaşi seringă cu soluţii alcaline sau acide.
Substanţa activă a preparatului se inactivează la acţiunea directă a razelor solare.
PREZENTARE, AMBALAJ
Soluţie injectabilă 10 mg/ml.
Câte 5 fiole în blister. Câte 2 blistere împreună cu instrucţiunea pentru administrare în cutie de carton.
PĂSTRARE
A se păstra la temperatura 2-8 °C, în ambalajul original.
A nu se lăsa la îndemâna şi vederea copiilor!
TERMEN DE VALABILITATE
2 ani.
A nu se utiliza după data de expirare indicată pe ambalaj.
STATUTUL LEGAL
Cu prescripţie medicală.
DATA ULTIMEI REVIZUIRI A TEXTULUI
Iulie 2014.
DEŢINĂTORUL CERTIFICATULUI DE &ÎNREGISTRARE
SAP "Firma farmaceutică "Darniţa", Ucraina
NUMELE ŞI ADRESA PRODUCĂTORULUI
SAP "Firma farmaceutică "Darniţa",
Ucraina, 02093, or. Kiev, str. Borispolskaya, 13.
0
Nu este disponibil
INDICATII
Hemoroizi si fisuri anale.
DOZE SI MOD DE ADMINISTRARE
Se administreaza intrarectal. Adulti - cate un supozitor de 2-3 ori/zi. Doza maxima nictemerala constituie 10 supozitoare. Cura de tratament 5-7 zile.
CONTRAINDICATII
Hipersensibilitate la preparat, glaucom, adenom de prostata.
Hemoroizi si fisuri anale.
DOZE SI MOD DE ADMINISTRARE
Se administreaza intrarectal. Adulti - cate un supozitor de 2-3 ori/zi. Doza maxima nictemerala constituie 10 supozitoare. Cura de tratament 5-7 zile.
CONTRAINDICATII
Hipersensibilitate la preparat, glaucom, adenom de prostata.
0
Nu este disponibil
Compozitie:
Fiecare supozitor contine 400 mg tribenosid, o substanta sintetica activa apartinand glucofuranozidelor si 40 mg lidocaina. 100 g crema contine 5 g tribenosid si 2 g lidocaina clorhidrat. Conservanti: Metilparaben (E 218) si propilparaben (E 216).
Proprietati/efecte:
Procto-Glyvenol determina diminuarea prompta a simptomelor hemoroizilor (durere, usturime, prurit, tensiune), care apar datorita inflamatiei secundare a regiunii anale. Activitatea terapeutica a Procto-Glyvenol la pacientii cu hemoroizi este atribuita capacitatii acestuia de a reduce permeabilitatea capilara si de a creste tonusul vascular. In plus, are efect antiinflamator local si actiune antagonista asupra unor substante endogene care au rol de mediatori ai inflamatiei si durerii. Lidocaina continuta de Procto-Glyvenol grabeste atenuarea simtomatologiei.
Farmacocinetica:
Absorbtie: Aprox. 20% din tribenosidul continut in crema se absoarbe prin piele. Biodisponibilitatea sistemica a tribenosidului este de 30% din cea obtinuta prin administrarea orala a acestuia (sub forma de capsule). Varful concentratiei plasmatice de 1 g/ml (tribenosid si metaboliti) se obtine la 2 ore dupa administrarea unui supozitor (400 mg tribenosid). Metabolism si eliminare: Tribenosidul se metabolizeaza intens si se excreta urinar (dintr-un supozitor, 20-27% din tribenosid se elimina sub forma de metaboliti). Cantitatea de lidocaina continuta de Procto-Glyvenol absorbita nu exercita nici un fel de efect asupra cordului.
Indicatii:
Pana la disparitia semnelor acute, crema sau 1 supozitor trebuie aplicate dimineata si seara. Ulterior, se poate continua tratamentul printr-o singura aplicare zilnica. 30 g crema sunt suficiente pentru 20-30 de aplicatii.
Contraindicatii:
Hipersensibilitate la unul din componentii Procto-Glyvenol.
Fiecare supozitor contine 400 mg tribenosid, o substanta sintetica activa apartinand glucofuranozidelor si 40 mg lidocaina. 100 g crema contine 5 g tribenosid si 2 g lidocaina clorhidrat. Conservanti: Metilparaben (E 218) si propilparaben (E 216).
Proprietati/efecte:
Procto-Glyvenol determina diminuarea prompta a simptomelor hemoroizilor (durere, usturime, prurit, tensiune), care apar datorita inflamatiei secundare a regiunii anale. Activitatea terapeutica a Procto-Glyvenol la pacientii cu hemoroizi este atribuita capacitatii acestuia de a reduce permeabilitatea capilara si de a creste tonusul vascular. In plus, are efect antiinflamator local si actiune antagonista asupra unor substante endogene care au rol de mediatori ai inflamatiei si durerii. Lidocaina continuta de Procto-Glyvenol grabeste atenuarea simtomatologiei.
Farmacocinetica:
Absorbtie: Aprox. 20% din tribenosidul continut in crema se absoarbe prin piele. Biodisponibilitatea sistemica a tribenosidului este de 30% din cea obtinuta prin administrarea orala a acestuia (sub forma de capsule). Varful concentratiei plasmatice de 1 g/ml (tribenosid si metaboliti) se obtine la 2 ore dupa administrarea unui supozitor (400 mg tribenosid). Metabolism si eliminare: Tribenosidul se metabolizeaza intens si se excreta urinar (dintr-un supozitor, 20-27% din tribenosid se elimina sub forma de metaboliti). Cantitatea de lidocaina continuta de Procto-Glyvenol absorbita nu exercita nici un fel de efect asupra cordului.
Indicatii:
Pana la disparitia semnelor acute, crema sau 1 supozitor trebuie aplicate dimineata si seara. Ulterior, se poate continua tratamentul printr-o singura aplicare zilnica. 30 g crema sunt suficiente pentru 20-30 de aplicatii.
Contraindicatii:
Hipersensibilitate la unul din componentii Procto-Glyvenol.
0
Nu este disponibil
INDICAȚII
- Externă și hemoroizi interni;
- Fisurile si eroziune a anusului;
- Proctită;
- Mâncărime Anal, eczeme și dermatite, zona perianală.
DOZARE
De droguri ar trebui să fie utilizat după procedurile de igienă. Introdus în rect de 1 suppozytoryyu la 4 timp / zi.
EFECT SECUNDAR
Poate: Reacții alergice locale (Hiperemia, mâncărime).
CONTRAINDICAȚII
- Bacteriene, fungice și virale în domeniul administrației;
- Tumorile zonei anorectale;
- Tuberculoza;
- Sindromul Cushing;
- Diabet sever;
- Gipernatriemiya;
- Sarcina;
- Alăptarea (alăptarea);
- Hipersensibilitate la medicament.
Sarcina și alăptarea
Nu utilizați acest medicament în timpul sarcinii și alăptării (alăptarea).
- Externă și hemoroizi interni;
- Fisurile si eroziune a anusului;
- Proctită;
- Mâncărime Anal, eczeme și dermatite, zona perianală.
DOZARE
De droguri ar trebui să fie utilizat după procedurile de igienă. Introdus în rect de 1 suppozytoryyu la 4 timp / zi.
EFECT SECUNDAR
Poate: Reacții alergice locale (Hiperemia, mâncărime).
CONTRAINDICAȚII
- Bacteriene, fungice și virale în domeniul administrației;
- Tumorile zonei anorectale;
- Tuberculoza;
- Sindromul Cushing;
- Diabet sever;
- Gipernatriemiya;
- Sarcina;
- Alăptarea (alăptarea);
- Hipersensibilitate la medicament.
Sarcina și alăptarea
Nu utilizați acest medicament în timpul sarcinii și alăptării (alăptarea).