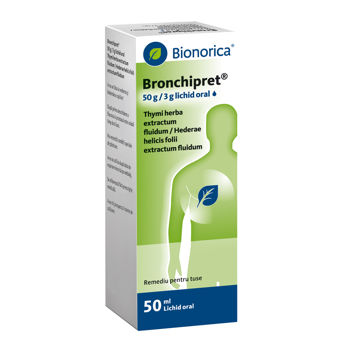
Bronchipret 100ml sirop lichid oral
- Livrare gratuită în Chișinău și regiuni
- Preț special online
- Achitare cu card
- Cumpără online, ridică în farmacie
- Află primul despre oferte speciale
112,20 lei
Adaugă în coş 2. COMPOZIȚIA CALITATIVĂ ȘI CANTITATIVĂ
100 g (89,2 ml) de lichid oral conține:
Substanțe active:
15 g extract fluid din părţi aeriene de cimbru (Thymi vulgaris herba, Thymi zygis herba) (1:2-2,5); agent de extracţie: soluţie de amoniu 10 % (m/m): glicerol 85 % (m/m): etanol 90 % (v/v): apă (1:20:70:109);
1,5 g extract fluid din frunze de iederă (Hederae helicis folii) (1:1); agent de extracţie: etanol 70 % (v/v).
Excipienţi: soluție de maltitol, sorbat de potasiu
Produsul conține alcool etilic – 7% (v/v).
Pentru lista tuturor excipienților, vezi pct. 6.1.
3. FORMA FARMACEUTICĂ
Lichid oral
Bronchipret Sirop este lichid transparent, de culoare cafenie-deschisă.
4. DATE CLINICE
4.1 Indicații terapeutice
Medicament pe bază de plante utilizat pentru tratamentul afecțiunilor inflamatorii ale căilor respiratorii cu acțiune expectorantă și de calmare a tusei.
4.2 Doze și mod de administrare
Dacă nu este prescris altfel, luați doza de Bronchipret Sirop pentru vârsta adecvată de 3 ori pe zi (dimineața, la prânz și seara) după cum este descris în tabelul de mai jos. Folosiți paharul de măsurare din cutie.
Înghițiți Bronchipret Sirop nediluat. Beți puțin lichid (preferabil apă), după luarea medicamentului.
A se agita bine înainte de fiecare utilizare!
4.3 Contraindicații
Bronchipret Sirop nu se va administra în caz de hipersensibilitate cunoscută la substanțele active sau Iederă, plantele din familia Araliaceae, Cimbru sau alte Labiate (Lamiaceae), sau la oricare dintre excipienții enumerați în pct. 6.1.
4.4 Atenționări și precauții special pentru utilizare
Dacă simptomele persistă mai mult de 7 zile, sau în cazul în care apar simptome ca dispnee, febră sau spută purulentă cu sânge, adresați-vă imediat medicului.
Pacienții cu gastrită sau ulcer gastric trebuie să administreze medicamentul cu precauție.
Medicamentul conține 7 % (v/v) alcool, adică până la 0,30 g alcool per 5,4 ml, echivalent cu 8 ml bere sau 3 ml vin. Poate fi dăunător persoanelor cu etilism. Acest lucru trebuie avut în vedere la femeile gravide sau care alăptează, copii și grupuri cu risc crescut, cum sunt pacienții cu boli hepatice sau epilepsie.
Copii:
Bronchipret Sirop nu se utilizează la copii mai mici de 2 an. În cazul tusei persistente sau recurente la copii cu vârsta 2-4 ani trebuie consultat medicul.
Notă pentru diabetici:
O singură doză de Bronchipret Sirop (5.4 ml) conține aproximativ 0.18 unități de pâine (UP).
Bronchipret Sirop conține soluție de maltitol.
Pacienții cu intoleranță ereditară rară la fructoză nu trebuie să utilizeze Bronchipret Sirop.
4.5 Interacțiuni cu alte medicamente și alte forme de interacțiune
În prezent, nu se cunosc interacțiuni cu alte medicamente.
Nu s-au efectuat studii privind interacțiunile posibile ale Bronchipret Sirop cu medicamente administrate concomitent.
4.6 Fertilitatea, sarcina și alăptarea
Nu sunt date suficiente despre administrarea preparatului în perioada de sarcină şi lactaţie. Astfel Bronchipret Sirop nu trebuie administrat femeilor însărcinate şi mamelor care alăptează.
Fertilitatea:
Nu există date privind efectul medicamentului asupra fertilității la om.
4.7 Efecte asupra capacității de a conduce vehicule și de a folosi utilaje
Bronchipret Sirop are o influență neglijabilă asupra capacității de a conduce vehicule sau de a folosi utilaje.
Acest medicament conține 7 % (v/v) alcool. O persoană sănătoasă descompune
cantitatea de alcool care este ingerată cu o singură doză, în decurs de câteva minute.
4.8 Reacții adverse
Similar altor medicamente, Bronchipret Sirop poate provoca reacții adverse.
Convenția MedDRA privind frecvența:
foarte frecvente (≥ 1/10) frecvente (≥ 1/100 și < 1/10)
mai puțin frecvente (≥ 1/1.000 și < 1/100) rare (≥ 1/10.000 și < 1/1.000)
foarte rare (<1/10.000)
Cu frecvența necunoscute (nu poate fi estimată din datele disponibile)
Tulburări ale sistemului imunitar:
rare – erupții cutanate (urticarie)
Cu frecvență necunoscută- dispnee, edem facial, edem al gurii și/sau faringelui.
Tulburări gastro-intestinale:
mai puțin frecvente: crampe intestinale, greață și vome, diaree.
În prospect, pacientul este instruit:
La primele semne ale oricărei reacții de hipersensibilitate, trebuie de întrerupt administrarea medicamentului.
Raportarea reacțiilor adverse suspectate
Raportarea reacțiilor adverse suspectate după autorizarea medicamentului este importantă. Aceasta permite monitorizarea în continuare a raportului beneficiu/risc al medicamentului. Profesioniștii din domeniul sănătății sunt rugați să raporteze orice reacții adverse suspectate, prin intermediul sistemului național de raportare disponibil pe site-ul oficial al Agenției Medicamentului și Dispozitivelor Medicale la următoarea adresă web: www.amdm.gov.md sau e-mail: farmacovigilenta@amdm.gov.md
4.9 Supradozaj
În caz de supradozaj, sunt posibile dureri abdominale, vome și diaree.
La ingerarea unor cantități mari de frunze de iederă poate apărea gastroenterită datorită saponinelor. Până în prezent, sunt disponibile numai rapoarte despre copii care au ingerat frunze proaspete de iederă. Datele publicate de la un centru de otrăviri arată că ingestia a 1-5 frunze de iederă, în cazuri rare, de până la 10 frunze de iederă și fructe proaspete a cauzat vome și diaree la 10% din 301 de copii. Este recomandată îndepărtarea toxinelor primare și administrarea de cărbune pentru copii mici care au ingerat 2 sau mai multe frunze proaspete de iederă. Aceste date nu pot fi folosite pentru a trage concluzii cu privire la efectele unei doze a preparatului cu conținut de frunze uscate de iederă, care sunt utilizate în acest medicament.
5. PROPRIETĂȚI FARMACOLOGICE
5.1 Proprietăți farmacodinamice
Grupa farmacoterapeutică: Expectorante, combinaţii. Codul ATC: R05CA10
Rezultatele din studiile in vitro și studiile pe animale, cu preparate din plante medicinale de cimbru și frunze de iederă sau principala sa componentă timol
sugerează efecte expectorante: extractul din părți aeriene din cimbru crește clearance-ul mucociliar și posedă proprietăți mucolitice.
Saponinele din frunzele de iederă stimulează mucoasa gastrică şi prin intermediul reflexului vagal intensifică secreţia bronhică, lichefiază mucusul bronhic şi facilitează eliminarea lui, manifestând astfel efect expectorant. Studiile in vitro și in vivo au demonstrat acțiune bronhodilatatoare pentru ambele substanțe active.
Studii ale preparatului Bronchipret Sirop au demonstrat efect puternic de calmare a tusei.
Studiile in vitro a Bronchipret au demonstrat activitate antiinflamatoare. Aceasta a fost confirmată și pe studiile in vivo efectuate pe animale cu tractul respirator inflamat.
Studiile in vitro realizate pe medicamentul Bronchipret au demonstrat proprietăți antibacteriene și antivirale împotriva bacteriilor aferente tractului respirator (spre exemplu S. pneumoniae S. pyogenes și M. catarrhalis) și tulpinilor virale (gripa A, virusul sincițial respirator, rinovirusul uman).
Nu există date disponibile cu privire la efectele farmacologice la om nici cu privire la componentele individuale, nici la combinația fixă.
5.2 Proprietăți farmacocinetice
Nu există date disponibile asupra farmacocineticii și biodisponibilității preparatelor din plantele medicinale: cimbru și frunzele de iederă.
5.3 Date preclinice de siguranță
Toxicitatea Thymi herba este joasa; DL 50 pentru uleiurile esentiale a fost determinată în concentrația de aproximativ 1,2%, ce variază de la o specie la alta intre 1,98 g/kg și 4,7 g/kg. DL 50 (șoareci) a extractului total constituie 34ml/kg.
Toxicitatea Hederae helicis folii este joasa dacă se administrează peroral. DL 50 este mai mult de 3g de extract per kg masă corp la soareci și semnificativ mai mult de 4,1 g la iepuri. A fost observată o creștere reversibilă a nivelului hematocritului, dar fără modificări organo-specifice într-un studiu de toxicitate subcronică cu pină la 750 mg/kg extract de Iederă pe o perioadă de 3 luni.
6. PROPRIETĂȚI FARMACEUTICE
6.1 Lista excipienților
Soluție de maltitol,
sorbat de potasiu (Ph. Eur.), acid citric monohidrat, hidroxipropilbetadex,
apă purificată.
6.2 Incompatibilități
Nu se cunosc.
6.3 Perioada de valabilitate
36 luni.
După deschiderea flaconului, utilizați medicamentul timp de 6 luni.
Nu utilizați acest medicament după data de expirare.
6.4 Precauții special pentru păstrare
A se pastra la loc uscat, ferit de lumina, la temperaturi sub 25°C.
În procesul păstrării este posibilă apariţia unei opalescenţe și floculări uşoare, care nu influenţează eficacitatea preparatului.
A se agita bine înainte de fiecare administrare
6.5 Natura și conținutul ambalajului
Câte 50 ml sau 100 ml sirop în flacon din sticlă brună. Câte 1 flacon împreună cu măsură dozatoare şi prospectul pentru pacient plasate în cutie de carton.
6.6 Precauții speciale pentru eliminarea reziduurilor
Nu sunt măsuri speciale de precauție.
7. DEȚINĂTORUL CERTIFICATULUI DE ÎNREGISTRARE
BIONORICA SE
Kerschensteinerstrasse 11-15
92318 Neumarkt Germania Telefon: 09181 / 231-90
Fax: 09181 / 231-265
E-Mail: info@bionorica.de
8. NUMĂRUL CERTIFICATULUI DE ÎNREGISTRARE
27889
9. DATA AUTORIZĂRII
27.06.2022
10. DATA REVIZUIRII TEXTULUI
Iunie 2022
Informaţii detaliate privind acest medicament sunt disponibile pe site-ul Agenţiei Medicamentului şi Dispozitivelor Medicale (AMDM) http://nomenclator.amdm.gov.md/
Specificații principale
- Producător Bionorica SE
- Țara producător Germania
- Article 103659
Produse asemănătoare
1 persoane se uită chiar acum la acest produs