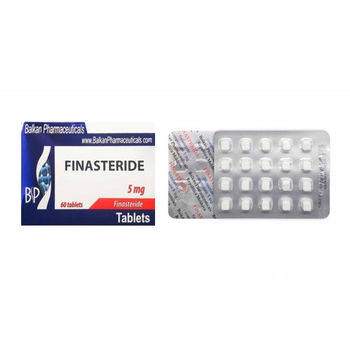
Finasterida 5mg comp. N20x3
- Livrare gratuită în Chișinău și regiuni
- Preț special online
- Achitare cu card
- Cumpără online, ridică în farmacie
- Află primul despre oferte speciale
Ă
Finasteridă
DCI-ul substanţei active
Finasteridum
COMPOZIŢIA
1 comprimat conţine:
substanţa activă: # nasteridă 1 mg;
excipienți: stearat de magneziu, crospovidonă (Kollidon®CL), Ludipress®
(lactoză monohidrat, polividonă, crospovidonă).
FORMA FARMACEUTICĂ
Comprimate.
DESCRIEREA MEDICAMENTULUI
Comprimate de culoare albă sau aproape albă, de formă pătrată, cu o linie
de divizare şi incrustaţie „BP” pe o parte a comprimatului şi cu inscripţia „1”
pe cealaltă parte a comprimatului, cu muchii teşite, suprafaţa laterală cu
margini rotunjite.
GRUPA FARMACOTERAPEUTICĂ şi codul ATC
Alte preparate dermatologice, codul ATC: D11AX10.
PROPRIETĂŢILE FARMACOLOGICE
Proprietăţi farmacodinamice
Finasterida este un 4-azasteroid de sinteză şi similar din punct de vedere
chimic cu testosteronul şi care acţionează ca un inhibitor competitiv şi spe- ci# c al 5 α-reductazei tip II, o enzimă intracelulară care transformă testosteronul într-un androgen mai potent, 5 α-dihidrotestosteron (DHT). Finasterida determină o scădere rapidă a concentraţiei serice de DHT, atingând
eliminarea semni# cativă în 24 ore de dozaj.
Foliculii părului conţin 5 α-reductază de tip II. La bărbaţii cu pierdere a părului de tip masculin, scalpul alopecic conţine foliculi de dimensiuni reduse
şi cantităţi crescute de 5α-dihidrotestosteron (DHT). Bărbaţii cu de# cienţă
genetică de 5α-reductază de tip II nu suferă de pierdere a părului de tip
masculin. Finasterida inhibă procesul responsabil de reducerea dimensiunilor foliculilor scalpului, care pot conduce la reversibilitatea procesului de
alopecie.
Studiile clinice efectuate la bărbaţi cu pierderea uşoară/moderată a părului
din vertex şi/sau frontală/centrală au demonstrat că: tratamentul cu # nasteridă timp de 5 ani a redus alopecia androgenetică comparativ atât cu rezultatele iniţiale cât şi cu placebo nu mai mult de 3 luni, şi au
generat creşterea părului la 6 luni (durata cea mai scurtă evaluată); e# cacitatea maximă a fost observată după un tratament de 2 ani. De aceea, # nasterida a stabilizat pierderea părului comparativ cu tratamentul cu placebo
la bărbaţii cu alopecie androgenetică. Suplimentar un studiu placebo-con- trolat pe o perioadă de 48 de săptămâni a demonstrat ca # nasterida a gene- rat transformarea foliculelor de păr într-o fază activă de creştere a părului.
Un studiu efectuat la femeile cu alopecie androgenetică a+ ate în perioada
de postmenopauză a indicat că # nasterida este ine# cientă comparativ cu
un tratament cu placebo de peste 12 luni.
Proprietăţi farmacocinetice
Biodisponibilitate
Biodisponibilitatea după administrarea orală a # nasteridei este aproximativ
80% şi nu este afectată de alimente. Concentraţia plasmatică maximă se
obţine în aproximativ 2 ore de la administrare şi absorbţia este completă
după 6-8 ore.
Distribuţia:
Se leagă în proporţie de aproximativ 93% de proteinele plasmatice. Volumul de distribuţie este de aproximativ 76 l (44-96 l). La starea de echilibru
concentraţia plasmatică maximă după o doză de 1 mg pe zi a fost în medie
9,2 ng/ml şi a fost atinsă în 1-2 ore de la administrare; ASC (0-24 ore) a fost
53 ng x ore/ml.
Finasterida a fost identi# cată în lichidul cefalorahidian (LCR), dar medicamentul nu pare a se concentra de preferinţă în LCR. De asemenea, o cantitate mică de # nasteridă a fost detectată în lichidul seminal al subiecţilor
trataţi cu # nasteridă.
Metabolizare:
Finasterida este metabolizată în principal prin intermediul sistemului
enzimatic al citocromului P450 3A4. După o doză orală de # nasteridă administrată la bărbaţi, au fost identi# caţi doi metaboliţi ai # nasteridei care
posedă numai o mică parte din activitatea inhibitorie a # nasteridei asupra
5α-reductazei.
Eliminare:
După administrarea orală a unei doze, aproximativ 39 % (32-46%) din doză
a fost excretată în urină sub formă de metaboliţi. Practic, nu a fost excretat
medicament nemodi# cat prin urină şi 57% (51-64%) din doza totală a fost
eliminată prin fecale.
Clearance-ul plasmatic este aproximativ 165 ml/min (70-279 ml/min).
Rata eliminării # nasteridei scade cu vârsta.
Timpul mediu de înjumătăţire plasmatică prin eliminare este de 5-6 ore (3-
14 ore) (8 ore la bărbaţi cu vârste mai mari de 70 de ani (6-15 ore)). Aceasta
nu are semni# caţie clinică şi nu implică o reducere a dozelor la vârstnici.
Insu" cienţa hepatică
Efectul insu# cienţei hepatice asupra farmacocineticii # nasteridei nu a fost
studiat.
Insu" cienţa renală
La pacienţii cu insu# cienţă renală cronică, cu clearance-ul creatininei cuprins în intervalul 9-55 ml/min, aria de sub curbă, concentraţia plasmatică
maximă, timpul de înjumătăţire plasmatică şi legarea de proteine a # nasteridei netransformate după o doză unică, au fost similare cu cele obţinute la
pacienţi sănătoşi.
INDICAŢII TERAPEUTICE
Finasteridă comp. 1 mg este indicat în tratamentul stadiului incipient al căderii părului (alopeciei androgenetice) la bărbaţi. Finasteridă , comprimate
stabilizează procesul alopeciei androgenetice la bărbaţii cu vârsta cuprinsă
între 18-41 de ani. Nu a fost determinată e# cacitatea sa în recesiunea bitemporală şi în fazele terminale de cădere a părului.
Nu este indicată administrarea # nasteridei la femei sau copii si adolescenti.
DOZE ŞI MOD DE ADMINISTRARE
Calea de administrare: orală.
Bărbaţi: 1 mg o dată pe zi cu sau fără alimente timp de 3-6 luni înainte ca
orice diferenţă să devină evidentă. Nu există dovezi că doze mai mari de
# nasteridă au o e# cacitate mai mare.
E# cacitatea şi durata trebuie evaluate permanent de medicul dumneavoastră. În general, este necesar un tratament continuu timp de 3-6 luni înaintea stabilizării procesului de cădere a părului. Este recomandat tratamentul
continuu pentru a obţine rezultatul dorit. Dacă tratamentul este întrerupt,
efectele bene# ce încep să dispară după 6 luni şi se revine la starea iniţială
după 9-12 luni.
Nu există date disponibile asupra administrării concomitente de Finasterida
cu minoxidil local pentru tratamentul împotriva căderii părului la bărbaţi.
Pacienţi vârstnici.
Nu este necesară ajustarea dozei la pacienţii vârstnici.
Pacienţi cu insu" cienţă renală.
Nu este necesară ajustarea dozei.
Pacienţi cu insu" cienţă hepatică.
Nu există date privind utilizarea # nasteridei la pacienţii cu
insu# cienţă hepatică.
Copii
Finasteridă comprimate este contraindicat la copii.
REACŢII ADVERSE
Se întâlnesc rar, de obicei sunt slab exprimate şi reversibile. Sunt posibile
scăderea potenţei şi libido-ului, reducerea volumului ejaculatului, tume# -
erea şi mărirea sânilor, rar – reacţii de hipersensibilitate (edemul buzelor,
erupţii cutanate). Frecvenţa dereglărilor sexuale scade pe parcursul trata- mentului.
Reacţiile adverse prezentate mai jos sunt clasi# cate în funcţie de frecvenţă, pe aparate, sisteme şi organe. Grupele de frecvenţă conform convenţiei
MedDRA: foarte frecvente(≥1/10), frecvente (≥ 1/100 şi < 1/10), mai puţin
frecvente (≥ 1/1000 şi < 1/100), rare(≥1/10000 şi <1/1000 ) şi foarte rare
(<1/10000), cu frecvenţă necunoscută (care nu poate # estimată din datele
disponibile).
Tulburări ale sistemului imunitar
Cu frecvenţă necunoscută: Reacţii de hipersensibilitate, inclusiv erupţii cutanate tranzitorii, prurit, urticaria şi edem al buzelor şi feţei.
Tulburări psihice
Mai puțin frecvente: libidou scăzut.
Tulburări cardiace
Cu frecvenţă necunoscută: palpitaţii.
Tulburări hepato-biliare
Cu frecvenţă necunoscută: creşterea valorilor enzimelor hepatice.
Afecţiuni cutanate şi ale ţesutului subcutanat
Mai puţin frecvente: erupţii cutanate tranzitorii.
Cu frecvenţă necunoscută: prurit, urticarie.
Tulburări ale aparatului genital şi sânului
Mai puţin frecvente: impotenţă, tulburări de ejaculare, scăderea volumului
de spermă.
Cu frecvenţă necunoscută: mărirea și sensibilitatea sînilor, durere testiculare,
infertilitate.
CONTRAINDICAŢII
Hipersensibilitate la componentele preparatului.
Finasterida este contraindicată la femei, copii şi adolescenţi.
Nu trebuie utilizat de către bărbaţii care utilizează deja Finasteridă de 5 mg
comprimate sau oricare alt inhibitor de 5 α-reductază pentru hipertro# a
benignă de prostată sau orice altă indicaţie.
SUPRADOZAJ
În studiile clinice, dozele unice de # nasteridă de până la 400 mg şi dozele
repetate până la 80 mg pe zi, timp de trei luni nu au determinat reacţii adverse. Nu este recomandat un tratament speci# c pentru supradozajul cu
Finasteridă.
ATENŢIONĂRI ŞI PRECAUŢII SPECIALE DE UTILIZARE
Finasterida nu trebuie utilizată la copii/adolescenţi (< 18 ani).
În studiile clinice efectuate cu Finasteridă la bărbaţi cu vârsta între 18-41
de ani, concentraţia plasmatică medie ale Antigenului Speci# c de Prostată
(PSA) a scăzut de la 0,7 ng/ml la 0,5 ng/ml în 12 luni. Această scădere a concentraţiilor PSA trebuie luată în considerare dacă în timpul tratamentului
cu Finasteridă, pacientul necesită un test PSA. În acest caz, valoarea PSA
trebuie dublată înainte de a face orice comparaţie cu rezultatele
pacienţilor netrataţi.
Datele pe termen lung privind fertilitatea la om lipsesc şi nu s-au efectuat
studii speci# ce la bărbaţii cu oligospermie. Pacienţii de sex masculin care
plani# cau procreerea unui copil au fost iniţial excluşi din studiile clinice.
Deşi studiile la animale nu au arătat efecte negative relevante asupra fer- tilităţii, după punerea pe piaţă au fost semnalate cazuri spontane de infertilitate şi/sau calitate afectată a lichidului seminal. În unele dintre aceste
cazuri, pacienţii prezentau şi alţi factori de risc care puteau contribui la
infertilitate. După întreruperea tratamentului cu # nasteridă a fost raportată
normalizarea sau îmbunătăţirea calităţii lichidului seminal. Pacienţii de sex
masculin care plani# că procreerea unui copil trebuie să ia în consideraţie
întreruperea tratamentului.
Nu a fost studiat efectul insu# cienţei hepatice asupra farmacocineticii # -
nasteridei.
Acest medicament conţine lactoză monohidrat. Pacienţii cu probleme ereditare rare de intoleranţă la galactoză, de# cit de lactoză (Lapp) sau sindrom
de malabsorbţie glucoză-galactoză nu trebuie să utilizeze acest medicament.
Perioada de sarcină şi alăptare.
Este contraindicat femeilor!!!
Comprimatele de # nasteridă sfărâmate sau rupte nu trebuie manipulate
de femei care sunt sau pot prezenta potenţial de a # gravide, datorită posibilităţii de absorbţie a # nasteridei şi dezvoltării ulterioare a anomaliilor
organelor genitale externe ale fătului.
Nu se cunoaşte dacă # nasterida este excretat în laptele uman.
Efecte asupra capacităţii de a conduce vehicule şi de a folosi utilaje
Nu există date disponibile care să demonstreze că ar afecta capacitatea de
a conduce vehicule sau de a folosi utilaje.
Specificații principale
- Producător BalkanPharm.
- Țara producător Bulgaria
- Article 57577