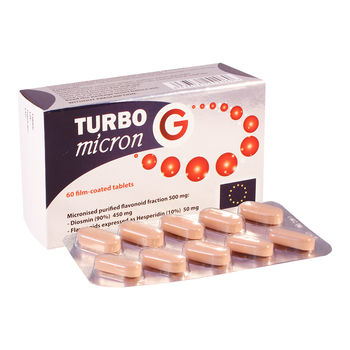
TURBO micron G 500mg comp. film. N60
- Livrare gratuită în Chișinău și regiuni
- Preț special online
- Achitare cu card
- Cumpără online, ridică în farmacie
- Află primul despre oferte speciale
Turbo micron G 500 mg comprimate filmate
2.
COMPOZIŢIA CALITATIVĂ ŞI CANTITATIVĂ
Fiecare comprimat filmat conţine:
Fracțiune flavonoidică purificată, micronizată, ce conține:
500 mg
Diosmină (90%)
450 mg
Flavonoide exprimate sub formă de hesperdină (10%)
50 mg
Pentru lista tuturor excipienților, vezi pct. 6.1.
3.
FORMA FARMACEUTICĂ
Comprimat filmat
Comprimate filmate de culoare portocalie, oblongi, cu diviziune diametrală pe una dintre fețe.
Diviziunea diametrală este destinată ruperii comprimatului pentru a facilita înghițirea acestuia și nu
pentru a-l diviza în doze egale.
4.
DATE CLINICE
4.1
Indicaţii terapeutice
Ameliorarea pe termen scurt a edemului și simptomelor asociate insuficienței venoase cronice la
adulți.
4.2.
Doze şi mod de administrare
Adulți
Doza terapeutică uzuală este de 2 comprimate pe zi, luate separat, un comprimat în timpul prânzului
și unui în timpul cinei.
Durata maximă a tratamentului este 2-3 luni.
Populația pediatrică
Siguranța și eficacitatea diosminei la copii și adolescenți nu au fost stabilite.
4.3.
Contraindicaţii
Hipersensibilitate la flavonoide sau la oricare dintre excipienţii medicamentului, enumerați la pct.
6.1.
4.4.
Atenţionări şi precauţii speciale pentru utilizare
Vezi pct. 4.6.
4.5.
Interacţiuni cu alte medicamente şi alte forme de interacţiune
fost
efectuate
studii
specifice
privind
posibilele
interacțiuni
farmacodinamice
și/sau
farmacocinetice ale diosminei cu alte medicamente sau alimente. Cu toate acestea, și luând în
special în considerare experiența vastă după punerea pe piață de utilizare a produsului, până în
prezent nu au fost raportate interacțiuni cu orice alte medicamente.
4.6.
Fertilitatea, sarcina şi alăptarea
Sarcina
Nu există dovezi de efecte nocive la om. Datele clinice documentate cu referire la un număr limitat
sarcini
expuse
indică
efecte
adverse
diosminei
asupra
sarcinii
dezvoltării
fetale/postnatale. Până în prezent nu sunt disponibile alte date epidemiologice relevante. Studiile pe
animale
indică
efecte
dăunătoare
directe
indirecte
asupra
sarcinii,
dezvoltării
embrionare/fetale, nașterii sau dezvoltării post-natale (vezi pct. 5.3).
Alăptarea
Nu se cunoaște dacă medicamentul este excretat în laptele uman. Cu toate acestea, în lipsa acestor
date, medicamentul nu trebuie utilizat pe parcursul perioadei de alăptare.
Fertilitatea
Nu a fost observată toxicitate asupra fertilității sau funcției de reproducere.
4.7.
Efecte asupra capacităţii de a conduce vehicule şi de a folosi utilaje
Diosmina nu influnețează sau are o influență neglijabilă asupra capacităţii de a conduce vehicule şi
de a folosi utilaje.
4.8.
Reacţii adverse
Reacțiile adverse sunt descrise mai jos, conform frecvenței:
Foarte frecvente (> 1/10),
Frecvente (> 1/100, <1/10),
Mai puţin frecvente (> 1/1000, <1/100),
Rare (> 1/10, 000, <1/1000),
Foarte rare (<1/10, 000),
Cu frecvență necunoscută (frecvența nu poate fi estimată reieșind din datele disponibile).
Tulburări gastrointestinale:
Frecvente: grețuri, vărsături, diaree, dispepsie.
Tulburări generale și la nivelul locului de administrare:
Rare: cefalee, stare de rău general, vertij.
Afecțiuni cutanate și ale țesutului subcutanat:
Rare: erupții cutanate tranzitorii, prurit, urticarie.
Raportarea reacţiilor adverse suspectate
Raportarea reacțiilor adverse suspectate după autorizarea medicamentului este importantă. Aceasta
permite monitorizarea în continuare a raportului beneficiu/risc al medicamentului. Profesioniștii din
domeniul
sănătății
sunt
rugați
raporteze
orice
reacții
adverse
suspectate,
prin
intermediul
sistemului
național
raportare
disponibil
site-ul
oficial
Agenției
Medicamentului
Dispozitivelor
Medicale
următoarea
adresă
web:
www.amed.md
mail:farmacovigilenta@amed.md.
4.9
Supradozaj
Nu au fost raportate cazuri de supradozaj.
5.
PROPRIETĂŢI FARMACOLOGICE
5.1 Proprietăţi farmacodinamice
Grupa
farmacoterapeutică:
medicamente
capilarostabilizatoare.
Bioflavonoide,
codul
ATC:
C05CA53
Diosmina
este
medicament
flebotonic
vasoprotector
(cauzând
venoconstricție,
creșterea
rezistenței și reducerea permeabilității venelor).
În modelele experimentale, diosmina exercită o acțiune dublă asupra sistemului venos retrograd:
- în vene și venule: crește tonusul parietal și manifestă acțiune antistază;
- la nivelul microcirculatiei: normalizează permeabilitatea și fortifică rezistenţa capilară.
La om, existența unor relații semnificative statistic doză/efect a fost stabilită pentru parametrii
pletismografiei
venoase:
capacitate,
distensibilitate
timp
golire.
bună
relație
doză/efect a fost observată la utilizarea dozei de 2 comprimate.
- Activitate flebotonică: diosmina creste tonusul venos. Pletismografia prin ocluzie venoasă, ce
utilizează un tensiometru cu mercur, a demonstrat o reducere a timpului de golire venoasă.
- Activitate microcirculatorie: la pacienții care prezintă semne de fragilitate capilară, medicamentul
crește rezistență capilară măsurată prin angiostereometrie.
5.2.
Proprietăţi farmacocinetice
Absorbţie
După administrare orală, diosmina este transformată rapid de către flora intestinală în intestine și
este absorbită sub forma de aglicon - diosmetină. Biodisponibilitatea orală este de aproximativ
57,9%.
Distribuție
Diosmetina este distribuit extensiv în țesuturi, cu un volum de distribuție de 62,1 l.
Biotransformare
Diosmetina este scindată rapid și extensiv în acizi flebotonici sau derivați conjugați cu glicina, care
sunt eliminați în urină. Acidul hidroxifenilpropionic, metabolitul predominant la om, este eliminat
mai ales sub formă de conjugat. Metaboliții determinați în cantități mai mici includ alți acizi
fenolici,
respectiv
acidul
1-hidroxi-4-metoxibenzoic,
3-metoxi-4-hidroxifenilacetic
3,4-
dihidroxibenzoic.
Eliminare
Eliminarea este relativ rapidă la om. În studiile efectuate cu diosmină marcată radioactiv 34% din
doză a fost regăsită în urină și fecale, după primele 24 ore, iar aproximativ 86% a fost regăsită în
urină și fecale după primele 48 ore.
Liniaritate/non-liniaritate
Farmacocinetica diosminei este liniară.
5.3
Date preclinice de siguranţă
Datele preclinice nu au elucidat un risc special pentru om.
6.
ROPRIETĂȚI FARMACEUTICE
6.1
Lista excipienţilor
Celuloză microcristalină (E-460i)
Gelatină
Amidon glicolat de sodiu (amidon de cartof)
Stearat de magneziu
Talc (E-553b)
Lauril sulfat de sodiu
Opadry portocaliu 03G34105, conținând:
Hipromeloză (E-464)
Glicerol
Dioxid de titan (E-171)
Oxid roșu de fer (E-172)
Oxid galben de fer (E-172)
Polietilenglicol 6000
Stearat de magneziu
6.2
Incompatibilităţi
Nu este aplicabil.
6.3
Termen de valabilitate
36 luni.
6.4
Precauţii speciale pentru păstrare
Acest medicament nu necesită condiții speciale de păstrare.
6.5
Natura şi conţinutul ambalajului
Blister transparent din aluminiu/PVC. Cutii conținând 60 comprimate.
6.6
Precauții speciale privind eliminarea reziduurilor și alte instrucțiuni de manipulare
Fără cerințe speciale.
Specificații principale
- Article 91683
- Țara producător E.U.
- Producător GM Pharmaceuticals Ltd.
- Cod medicament 0408470063
Produse asemănătoare
1 persoane se uită chiar acum la acest produs